 |
Главная |
Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов.
|
из
5.00
|
Лекция 20
Основы кинетики химических реакций
Разница между дыханием и горением только в скорости процесса.
А.Л. Лавуазье
План:
1. Химическая кинетика. Предмет и основные понятия химической кинетики. Скорость реакции
2. Молекулярность и порядок реакции. Период полупревращения
3. Константа скорости реакции, ее определение. Закон действующих масс
4. Механизм химических реакций. Классификация сложных реакций
5. Теория активных соударений. Энергия активации. Зависимость скорости реакции от природы реагирующих веществ и температуры
1. Химическая кинетика. Предмет и основные понятия химической кинетики. Скорость реакции
О направлении, глубине и принципиальной возможности протекания процесса судят по величине изменения свободной энергии (ΔG≤0). Однако эта величина не говорит о реальной возможности протекания реакции в данных условиях.
Например, реакция взаимодействия закиси азота с кислородом протекает мгновенно при комнатной температуре: 2 NO(г) + О2(г) = 2NO2 (г),
∆G=-35,08 кДж/моль. В то же время 2Н2(г) + О2(г) = 2Н2О(ж), Δ°G = -286,8 кДж/моль - реакция, характеризующаяся значительно большим уменьшением свободной энергии, в обычных условиях взаимодействие не протекает, но при 700 °С или в присутствии катализатора процесс протекает мгновенно. Следовательно, термодинамика не отвечает на вопрос условий и скорости протекания процесса. В этом проявляется ограниченность термодинамического подхода. Для описания химической реакции необходимо знать также закономерности ее протекания во времени, которые изучает кинетика.
Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов.
В зависимости от того, в одной или нескольких фазах находятся компоненты реакции, различают кинетику гомогенных и гетерогенных реакций. По механизму реакции делятся на простые и сложные, поэтому выделяют кинетику простых и сложных реакций.
Основным понятием кинетики реакции является скорость химической реакции. Определение скорости химических реакций имеет биологическое и народно-хозяйственное значение.
Скорость химической реакции определяется количеством вещества, прореагировавшего за единицу времени в единице объема (в случае гомогенных реакций, когда реагирующие вещества находятся в одной фазе) или на единице поверхности раздела фаз (в случае гетерогенных реакций, когда реагирующие вещества находятся в различных фазах).
Скорость реакции характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в функции времени. Уравнение, описывающее зависимость скорости реакции (v) от концентрации (с) реагирующих веществ, называется кинетическим. Скорость реакции чаще выражают в моль/л-с, в биохимии в мг/100мл-с, или в массовой доле, в %/100 мл-с. Различают среднюю скорость реакции в интервале времени и истинную скорость реакции в определенный момент времени. Если в интервале времени t1 и t2 концентрация одного из исходных веществ или продуктов реакции равна соответственно с1 и с2, то среднюю скорость реакции (v) в интервале времени t1 и t2 можно выразить:
v = 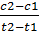 (1)
(1)
Поскольку речь идет в данном случае об убыли концентрации исходного вещества, т.е. изменение концентрации вещества берется в этом случае со знаком «минус» (-). Если скорость реакции оценивается изменением (увеличением) концентрации одного из продуктов реакции, то со знаком «плюс» (+):
V = ± 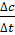 (2)
(2)
По уравнению (2) определяют среднюю скорость химической реакции. Истинную (мгновенную) скорость реакции определяют графически. Строят график зависимости концентрации исходного вещества или продукта реакции (Са) от времени (t) - кинетическую кривую реакции Са - f(t) для нелинейного процесса (рис. 1).
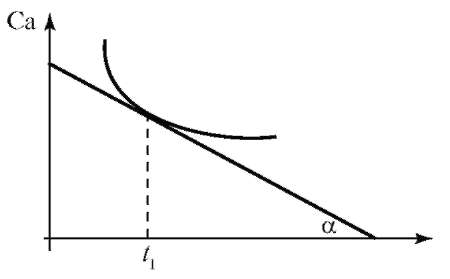
Рис. 1. Кинетическая кривая
Исследование скорости химической реакции позволяют получить информацию о ее механизме. Помимо концентрации скорость реакции зависит от природы реагентов, внешних условий и наличия катализатора.
|
из
5.00
|
Обсуждение в статье: Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

