 |
Главная |
Теория активных соударений. Энергия активации. Зависимость скорости реакции от природы реагирующих веществ и температуры
|
из
5.00
|
Для того чтобы совершился элементарный акт химического взаимодействия, реагирующие частицы должны столкнуться друг с другом. Однако не каждое столкновение приводит к химическому взаимодействию. Последнее происходит в том случае, когда частицы приближаются на расстояния, при которых возможно перераспределение электронной плотности и возникновение новых химических связей. Взаимодействующие частицы должны обладать энергией, достаточной для преодоления сил отталкивания, возникающих между их электронными оболочками.
Переходное состояние - состояние системы, при котором уравновешены разрушение и создание связи. В переходном состоянии система находится в течение небольшого (10-15 с) времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации. В многоступенчатых реакциях, которые включают в себя несколько переходных состояний, энергия активации соответствует наибольшему значению энергии. После преодоления переходного состояния молекулы вновь разлетаются с разрушением старых связей и образованием новых или с преобразованием исходных связей. Оба варианта возможны, так как происходят с высвобождением энергии. Существуют вещества, способные уменьшить энергию активации для данной реакции.
Активные молекулы А2 и B2 при столкновении объединяются в промежуточный активный комплекс А2...В2 с ослаблением, а затем и разрывом связей А-А и В-В и упрочнением связей А-В.

«Энергия активации» реакции образования HI (168 кДж/моль) значительно меньше, чем энергия, необходимая для полного разрыва связи в исходных молекулах Н2 и I2 (571 кДж/моль). Поэтому путь реакции через образование активного (активированного) комплекса энергетически более выгоден, чем путь через полный разрыв связей в исходных молекулах. Через образование промежуточных активных комплексов происходит подавляющее большинство реакций.
Энергия активации представляет собой избыток кинетической энергии частиц относительно средней энергии, необходимой для химического превращения сталкивающихся частиц. Реакции характеризуются различными величинами энергии активации (Еа).
В большинстве случаев энергия активации химических реакций между нейтральными молекулами составляет от 80 до 240 кДж/моль. Для биохимических процессов значения Еа зачастую ниже - до 20 кДж/моль. Это объясняется тем, что абсолютное большинство биохимических процессов протекает через стадию фермент-субстратных комплексов. Энергетические барьеры ограничивают протекание реакции. Благодаря этому в принципе возможные реакции (при G <0) практически всегда не протекают или замедляются.
Реакции с энергией активации выше 120 кДж/моль настолько медленны, что их протекание трудно заметить.
Для осуществления реакции молекулы при столкновении должны быть определенным образом ориентированы и обладать достаточной энергией. Вероятность надлежащей ориентации при столкновении характеризуют с помощью энтропии активации ΔSa. Перераспределению электронной плотности в активном комплексе благоприятствует условие, когда при столкновении молекулы А2 и В2 ориентированы, как это показано на рис. 2, а, тогда как при ориентации, показанной на рис. 2, б, вероятность реакции еще гораздо меньше - на рис. 2, в.

Рис.2 Благоприятная (а) и неблагоприятные (б, в) ориентации молекул
А2 и В2 при столкновении
Уравнение, характеризующее зависимость скорости и реакции от температуры, энергии активации и энтропии активации, имеет вид:
K = Ae–E/RT (2.8) или lgk = lgA-  (8)
(8)
где k - константа скорости реакции; A - в первом приближении общее число столкновений между молекулами за единицу времени (секунду) в единице объема; е - основание натуральных логарифмов; R - универсальная газовая постоянная; Т - абсолютная температура; Еа - энергия активации.
Уравнение (8) выведено Аррениусом в 1889 году. Предэкспо-ненциальный множитель A пропорционален общему числу соударений между молекулами в единицу времени. Его размерность совпадает с размерностью константы скорости и, следовательно, зависит от суммарного порядка реакции. Экспонента равна доле активных соударений от их общего числа, т.е. столкнувшиеся молекулы должны иметь достаточную энергию взаимодействия.
При обсуждении закона действующих масс для скорости (6) специально было оговорено, что константа скорости есть постоянная величина, не зависящая от концентраций реагентов. При этом предполагалось, что все химические превращения протекают при постоянной температуре. Вместе с тем хорошо известно, что быстрота химического превращения может существенно изменяться при понижении или повышении температуры. С точки зрения закона действующих масс это изменение скорости обусловлено температурной зависимостью константы скорости, так как концентрации реагирующих веществ лишь незначительно меняются вследствие теплового расширения или сжатия жидкости.
Наиболее хорошо известным фактом является возрастание скорости реакций с увеличением температуры. Такой тип температурной зависимости скорости называется нормальным (рис. 3, а). Этот тип зависимости характерен для всех простых реакций.

Рис. 3. Типы температурной зависимости скорости химических реакций: а - нормальная; б - аномальная; в - ферментативная
Однако в настоящее время хорошо известны химические превращения, скорость которых падает с увеличением температуры. В качестве примера можно привести газофазную реакцию азота (II) оксида с бромом (рис. 3, б). Такой тип температурной зависимости скорости называется аномальным.
Из уравнения Аррениуса для k видно, что, поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Зависимость скорости гомогенной реакции от температуры может быть выражена правилом Вант-Гоффа, согласно которому при увеличении температуры на каждые 10° скорость реакции возрастает в 2-4 раза; число, показывающее во сколько раз возрастает скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом скорости реакции - γ.
γ = 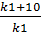 = 2:4 (9)
= 2:4 (9)
где k - константа скорости при температуре t °C. Зная величину γ, можно рассчитать изменение скорости реакции при изменении температуры от T1 до T2 по формуле:
v(T2)/v(T1) = γ (T2-T1)/10 . (10)
При повышении температуры в арифметической прогрессии скорость возрастает в геометрической.
Например, если γ = 2,9, то при возрастании температуры на 100° скорость реакции увеличивается в 2,910 раз, т.е. в 40 тыс. раз. Отклонения от этого правила составляют биохимические реакции, скорость которых увеличивается в десятки раз при незначительном повышении температуры.
Это правило справедливо лишь в грубом приближении. Реакции, в которых участвуют крупные молекулы, характеризуются большим температурным коэффициентом.
Для многих химических реакций закон действующих масс для скорости неизвестен. В таких случаях для описания температурной зависимости скорости превращения может применяться выражение:
v = Ac* e – (Ea / RT) (11)
Предэкспонента Ас не зависит от температуры, однако зависит от концентрации. Единицей измерения является моль/л•с.
Теоретическая зависимость позволяет заранее рассчитывать скорость при любой температуре, если известны энергия активации и предэкспонента.
Таким образом, прогнозируется влияние температуры на быстроту протекания химического превращения.
Вопросы для самоконтроля:
1. Какие реакции называются гомогенными, а какие гетерогенными? Приведите по одному примеру каждого типа реакций.
2. Какие реакции называют простыми, а какие сложными? Приведите по два примера простых и сложных реакций.
3. В каком случае молекулярность и порядок кинетического уравнения могут численно совпадать?
4. Скорость некоторой реакции с течением времени не изменяется. Изменится ли с течением времени период полупревращения этой реакции, и если изменится, то как? Дайте объяснение.
5. В каком случае истинная (мгновенная) скорость и средняя скорость реакции (в достаточно большом интервале времени) могут совпадать?
6. Вычислите константу скорости реакции A + B → AB, если при концентрациях веществ A и B, равных соответственно 0,5 и 0,1 моль/л, ее скорость равна 0,005 моль/л•мин.
7. Период полупревращения некоторой реакции первого порядка равен 30 мин. Какая часть от первоначального количества вещества останется через час?
8. Дать понятие общего порядка реакции и порядка реакции по веществу.
9. Основной закон химической кинетики.
10. Дать понятие механизма химических реакций.
11. Простые и сложные реакции.
12. Сопряженные реакции. От каких факторов зависит константа скорости химических реакций?
13. Скорость реакции действительно пропорциональна произведению концентраций реагирующих веществ в степени их стехиометри-ческих коэффициентов?
14. Какие требуются экспериментальные данные для определения порядка реакций?
15. Напишите кинетическое уравнение реакции H2O2 + 2HI → I2 + + 2H2O, если смешаны равные объемы 0,02 моль/л раствора H2O2 и 0,05 моль/л раствора HI. Константа скорости 0,05 л/моль•с.
16. Напишите кинетическое уравнение реакции H2O2 + 2HI → I2 + + 2H2O, учитывая, что она характеризуется первым порядком реакции по концентрациям обоих исходных веществ.
17. Докажите, что скорость химической реакции максимальна при стехиометрическом соотношении компонентов.
18. Перечислите возможные объяснения влияния температуры на скорость реакции.
|
из
5.00
|
Обсуждение в статье: Теория активных соударений. Энергия активации. Зависимость скорости реакции от природы реагирующих веществ и температуры |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

