 |
Главная |
Общие сведения о ректификации
|
из
5.00
|
Ректификация – это процесс разделения гомогенных смесей летучих жидкостей путем двустороннего массообмена и теплообмена между неравновесными жидкой и паровой фазами, имеющими различную температуру и движущимися относительно друг друга. При этом пар непрерывно обогащается низкокипящим (легколетучим) компонентом, а жидкость – высококипящим (труднолетучим) компонентом. Ректификацией может быть достигнута любая заданная степень разделения жидких смесей. Ректификация является сложным процессом дистилляции.
Процессы ректификации осуществляются периодически или непрерывно при различных давлениях: под атмосферным давлением, под вакуумом (для разделения смесей высококипящих веществ), а также под давлением больше атмосферного.
На процесс протекания ректификации влияют многие различные факторы.
Флегмовое число определяет размеры аппарата и расход теплоносителей (греющего пара в кубе-испарителе и охлаждающей воды в дефлегматоре). Следовательно, от величины флегмового числа зависят капитальные затраты и эксплуатационные расходы на ректификацию. С увеличением флегмового числа высота аппарата уменьшается, а расход греющего пара возрастает.
На процесс ректификации влияет также скорость потоков. При выборе оптимальных условий работы ректификационной установки необходимо учитывать расход тепла и основные параметры (температуру и давление) теплоносителей – греющего пара и охлаждающей воды, а также требуемые размеры, как самой колонны, так и соединенных с ней теплообменных аппаратов (кипятильника, нагревателя исходной смеси, дефлегматора и холодильника паров). Все эти факторы взаимосвязаны и зависят, в частности, от температуры и агрегатного состояния подаваемой на разделение смеси.
Для проведения процесса ректификации применяют в основном аппараты колонного типа. В зависимости от способа создания поверхности фазового контакта эти аппараты подразделяют на две группы:
- аппараты, в которых поверхность фазового контакта является поверхность жидкости, растекающейся по специальной насадке (насадочные колонны);
- аппараты, в которых поверхность фазового контакта создается потоками пара и жидкости (барботажные колонны).
Насадочные колонны имеют меньшее гидравлическое сопротивление по сравнению с барботажными. Низкое гидравлическое сопротивление существенно лишь при ректификации в вакууме. Также насадочные колонны применяют для разделения химически агрессивных веществ.
Барботажные (тарельчатые) ректификационные колонны являются наиболее эффективными и распространенными аппаратами, благодаря возможности разделения в них компонентов с любой степенью чистоты. Они изготавливаются в виде вертикальных цилиндров, внутри которых одна над другой размещено определенное количество горизонтальных перегородок – тарелок. Тарелки бывают различного типа: колпачковые, ситчатые, клапанновые, капсульные, тоннельные и другие.
Наибольшее применение находят колпачковые, ситчатые и клапанновые тарелки.
Пример расчета ректификационной колонны:
2 Специальная часть
Расчет тарельчатой ректификационной колонны 
Исходные данные расчета ректификационной тарельчатой колонны непрерывного действия для разделения бинарной смеси летучих компонентов.
Ацетон - бензол (СН3)2СО - C6H6
GF – 8200,0 кг/ч 



XD – 96,0 % мас.д
XF – 30,0 % мас.д 
XW – 2,0 % мас.д
t Н - 25°С
Рг.п - 4,0 ат
2. 1 Расчет материального баланса
2.1.1 Выполняем пересчет исходных концентраций в мольные доли по формуле:





где  - мольные доли компонентов А и В;
- мольные доли компонентов А и В;
 - молекулярные массы компонентов А и В.
- молекулярные массы компонентов А и В.
 (CH3)2CO = (12+1∙3) ∙2+12+16 = 58 НК
(CH3)2CO = (12+1∙3) ∙2+12+16 = 58 НК
 C6H6 = 12∙6+1∙6 = 78 ВК
C6H6 = 12∙6+1∙6 = 78 ВК



2.1.2 Материальный баланс ректификационной колонны рассчитывается по формуле:
GF = GD+GW по всему потоку
GF ∙XF = GD ∙XD + GW ∙XW по НК, (2, с 354)
где GD, GW, GF – количество дистиллята, остатка и исходной смеси, кг;
XD, XW, XF – состав соответственно дистиллята, остатка и питания в массовых долях.
Совместным решением двух уравнений определяется GD и GW:
GF ∙XF = GD ∙XD + GW ∙XW
GD = GF - GW
GF ∙XF = (GF - GW ) ∙XD + GW ∙XW
GF ∙XF = GF ∙XD - GW ∙XD + GW ∙XW
GF ∙XF = GF ∙XD - GW ∙(XD - XW)
GW ∙(XD - XW) = GF ∙XD - GF ∙XF
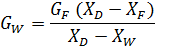

GD = GF - GW
GD = 8200 – 5757,4 = 2442,6 кг/ч
2.2 Построение диаграммы «t-x-y»
2.2.1 Построение диаграммы «t-x-y» по мольным долям и значениям равновесных составов (Приложение 2).
Масштаб: x, y 1 – 300мм x = 30 мм
0,1 – x мм
Масштаб: t 300 – 50мм x = 6 мм - 1°C
x – 1мм
Таблица 2.1
Состав фаз разделяемой системы
| Наименование компонентов при состоянии равновесия | Содержание компонентов бинарной смеси | |||||||||||
| В мольных % и в ºC | ||||||||||||
| X | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| Y | 0 | 14 | 25 | 40 | 50 | 60 | 68,5 | 75,5 | 82,5 | 88,5 | 94,5 | 100 |
| t | 80,1 | 78,3 | 76,4 | 72,8 | 69,6 | 66,7 | 64,3 | 62,4 | 60,7 | 59,6 | 57,6 | 56,2 |
| Наименование компонентов при состоянии равновесия | Содержание компонентов бинарной смеси | |||||||||||
| В мм | ||||||||||||
| X | 0 | 15 | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 | 300 |
| Y | 0 | 42 | 75 | 120 | 150 | 180 | 206 | 227 | 248 | 266 | 284 | 300 |
| t | 481 | 470 | 459 | 437 | 418 | 400 | 386 | 374 | 364 | 358 | 346 | 337 |

2.2.2 Рассчитываем значения равновесных составов в мольных долях
XW = 0,027 0,027 – x мм XW = 8,1 мм
0,1 – 30 мм
XF = 0,366 0,366 – x мм XF = 109,8 мм
0,1 – 30 мм


XD = 0,97 0,97 – x мм XD = 291 мм
0,1 – 30 мм
2.3 Расчет минимального флегмового числа по формуле:

где XD – мольная доля НК в дистилляте;
XF – мольная доля НК в исходной смеси;
Y*F – мольная доля НК в паре, равновесном с жидкостью состава XF (находится по диаграмме «t-x-y»).

 ,
,
где R – рабочее флегмовое число;
(1,2÷2,5) – коэффициент избытка флегмы, принимаем 2.
R = 2∙ 2,12 = 4,22
2.4 Построение диаграммы «y – x» и определение числа ступеней (Приложение 3).
Определяем число ступеней изменения концентрации (числа теоретических ступеней) графическим путем. Для этого осуществляем построение рабочих линий на диаграмме «y – x».
Для построения рабочих линий откладывают на оси абсцисс диаграммы «y – x» заданные составы жидкостей XF, XW, XD. С учетом принятых допущений о равенстве состава пара, уходящего с верхней тарелки, и дистиллята (YD = XD) из точки XD восстанавливают вертикаль до пересечения с диагональю диаграммы в точке а. Величину R считаем известной.


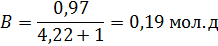
Откладывают на оси ординат отрезок B (т. d). Соединяют прямой точку d с точкой a. Из точки, отвечающей составу XF, проводят вертикаль до пересечения с линией ad в точке b. Прямая ab – рабочая линия укрепляющей (верхней) части колонны. Согласно допущению YW = XW, из точки соответствующей составу XW, восстанавливают вертикаль до пересечения с диагональю диаграммы и получают точку c. Соединяют точку c прямой с точкой b, принадлежащей одновременно рабочим линиям укрепляющей и исчерпывающей частей колонны. Прямая bc представляет рабочую линию исчерпывающей (нижней) части колонны.
Число теоретических тарелок определяется графически, путем построения ступеней между рабочими линиями и линией равновесия, начиная от т. a и заканчивая в т. c. Каждая ступень соответствует одной теоретической тарелке.
Число теоретических ступеней (по графику)
nв = 11
nн = 11
Число практических тарелок подсчитывается, принимая КПД тарелки
 принимаем
принимаем
η = 0,5
nв = 11/0,5 = 22
nн = 11/0,5 = 22
2.5 Расчет расхода паров поднимающихся в колонне
 ,
,
где : GV – расход паров, кг/ч;
R – флегмовое число;
GD – расход дистиллята, кг/ч.
GV = 2442,6 ∙ (4,22+1) =12750,4 кг/ч
2.5.1 Определяем средний мольный состав пара в колонне:

где: Y1, Y2 – средний мольный состав пара в верхней и нижней части колонны.


где: Ya, Yb, Yc – состав пара соответственно в точках a, b, c (находятся по диаграмме «y - x») .
т. а - XD = YD = 0,97
т. c - XW = YW = 0,027
т. b – YF = 0,46



2.5.2 По диаграмме «t-x-y» находится температура, соответствующая среднему содержанию, и при этой температуре определяется средняя плотность пара по формуле:

где ρп – плотность пара, кг/м3;
М – молекулярная масса, кг/кмоль;
Р – рабочее давление в колонне, Па;
Т – температура, °К ( Т=273+69,8 = 342,8).
– Молекулярная масса пара определяется по формуле:
 ,
,
где Мнк, Мвк – молекулярная масса соответственно НК и ВК.
Мп = 58∙0,485 + 78∙(1 – 0,495) = 68,9 кг/кмоль

2.5.3 Объемный расход пара определяется по формуле:

 12750,4 / 2,5 = 5100 м3/
12750,4 / 2,5 = 5100 м3/
2.6 Расчет расхода жидкости стекающей по колонне
2.6.1 В верхней части колонне определяется по формуле:

где Vж.в. – расход жидкости в верхней части колонны, м3/с;
GD – расход дистиллята, кг/ч;
R – флегмовое число;
Мср.в. – средняя мольная масса жидкости в верхней части колонны, кг/кмоль;
МD – мольная масса дистиллята, кг/кмоль;
ρж – средняя плотность жидкости, кг/м3.
2.6.2 Средняя плотность жидкости определяется по формуле:
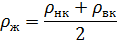
 - выбирают по справочной литературе при температуре верха и низа колонны. Температура верха и низа колонны определяется по диаграмме
- выбирают по справочной литературе при температуре верха и низа колонны. Температура верха и низа колонны определяется по диаграмме
«t-x-y».
tв – XD = 56,5 ° C
tн – XW = 79,1 ° C
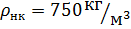
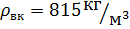

2.6.3 В нижней части колонны определяется по формуле:

где Vж.н. – расход жидкости в нижней части колонны, м3/с;
GF – расход исходной смеси, кг/ч;
MF – мольная масса исходной смеси, кг/кмоль;
Мср.н – средняя мольная масса жидкости в нижней части колонны, кг/ч.
2.6.4 Определение среднего состава жидкости в верхней и нижней части колонны
– средний состав жидкости в верхней части колонны определяется по формуле:

– средний состав жидкости в нижней части колонны определяется по формуле:

где: XF, XD, XW – мольный состав исходной смеси, дистиллята и остатка.
– средний мольный состав жидкости в колонне:




2.6.5 Средняя мольная масса жидкости в верхней части колонны определяется по формуле:

Мср.в = 58∙0,668 + 78∙(1 – 0,668) = 64,6 кг/кмоль
– мольная масса дистиллята определяется по формуле:

MD = 58∙0,97 + 78∙(1 – 0,97) = 58,6 кг/кмоль
2.6.6 Средняя мольная масса жидкости в нижней части колонны определяется по формуле:

Мср.н = 58∙0,196 + 78∙(1 – 0,196) = 74,1 кг/кмоль
–мольная масса исходной смеси определяется по формуле:

MF = 58∙0,366 + 78∙(1 – 0,366) = 70,7 кг/кмоль
2.6.7 Средний расход жидкости в колонне определяется по формуле:



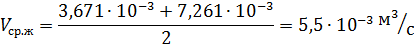
2.7 Расчет основных размеров колонны
2.7.1 Определяем площадь сечения колонны по формуле:

где S – площадь сечения, м 2;
 - средний объемный расход пара,
- средний объемный расход пара,  ;
;
W – рабочая скорость, м / с;
− Скорость рабочая определяется в зависимости от скорости предельной и отношения плотностей пара и жидкости по графику:

2,3/782,5 = 0,0029 = 2,9 ∙ 10-3 кг/м3
Принимаем Wпред. = 0,9 м/с

W = 0,9 ∙ 0,9 = 0,81 м/с
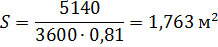
2.7.2 Определяем диаметр колонны по формуле:

где Д – диаметр колонны, м;
S – площадь сечения колонны, м2.

Принимаем диаметр колонны равный 1600 мм в соответствии с литературными данными /3; с 627/.
2.7.3 Определяем высоту колонны
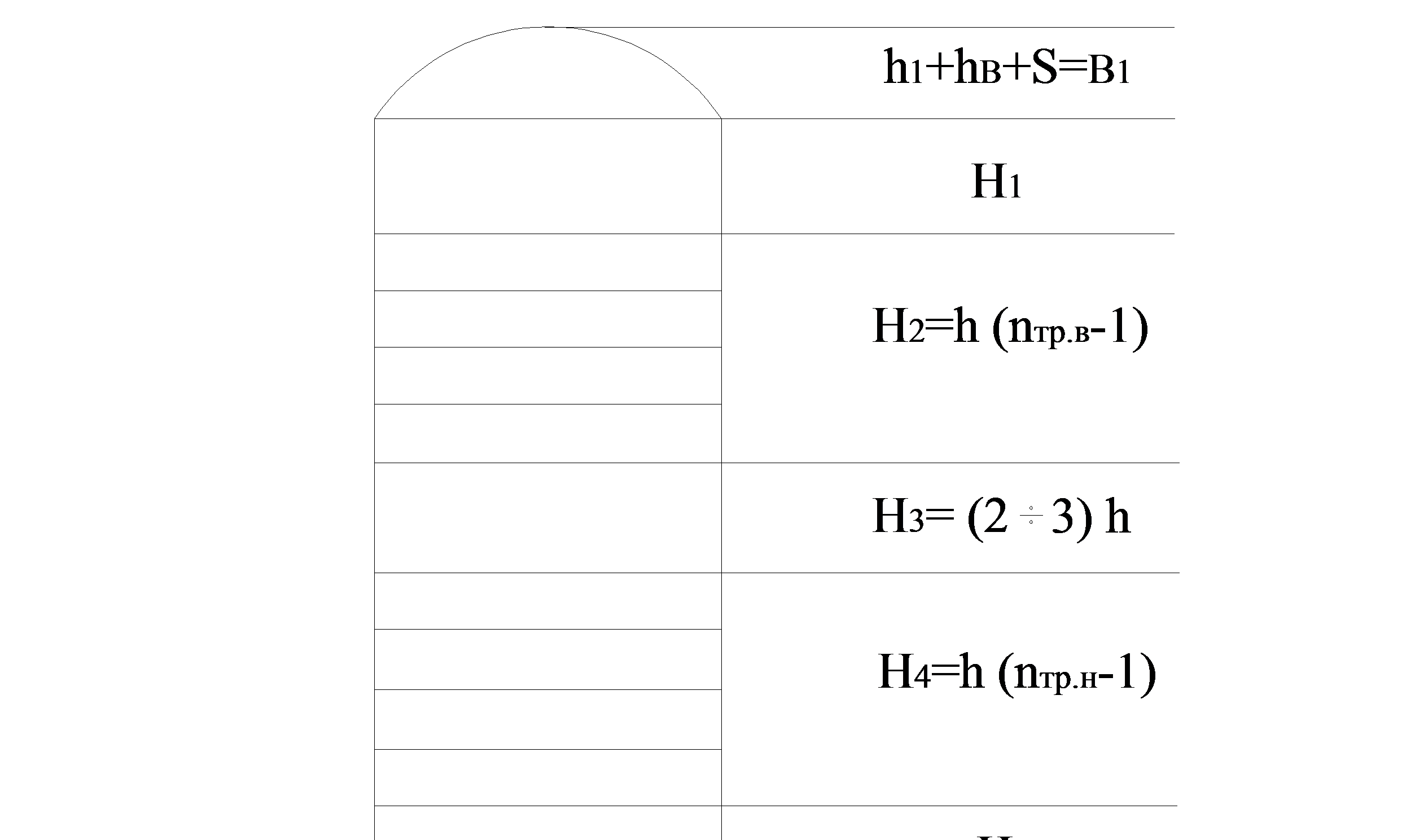
Рисунок 2.3 Схема высоты колонны
в1, в2 – днища;
Н1 – высота сепарационной части;
Н2 – верхняя тарельчатая часть;
Н3 – высота питательной тарелки;
Н4 – нижняя тарельчатая часть;
Н5 – высота кубовой части.
h = 450мм = 0,45 м
h1 = 60мм = 0,06 м
hВ = 300мм = 0,30 м
S = 30мм = 0,03 м
H1 = (0,6÷1,5)
H1 = 1,32 принимаем
H5 = (0,6÷1,5)
H5 = 1,50 принимаем
Высоту колонны определяем конструктивно:
в1= в2= 0,06+ 0,30+ 0,03 = 0,39 м
Н2= 0,45∙ (18 – 1) = 7,65 м
Н4= 0,45∙ (10 – 1) = 4,05 м
Н = 1,32+ 7,65+ 0,90+ 4,05+ 1,50+ 0,39 ∙ 2 = 16,20 м
2.8 Расчет гидравлического сопротивления тарелки
Из таблицы /3; с 627/ для принятого диаметра колонны выписывают следующие показатели:
 = 63
= 63
П = 1000 мм = 1 м
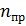 = 30
= 30
Sпр = 4 × 20 мм = 0,004 × 0,02 м
S = 0,785 ∙ (1,6)2 = 2,01 м2
2.8.1 Фактическое живое сечение прорезей на одной тарелке составляет:

где:  – количество колпачков на тарелке;
– количество колпачков на тарелке;
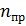 – количество прорезей в колпачке;
– количество прорезей в колпачке;
Sпр – площадь сечения прореза, м2;
S0 – живое сечение прорезей, м2.
S0 = 63∙ 30∙ 0,004∙ 0,02 =0,15 м2
2.8.2 Определяем φ – отношение живого сечения прорезей к площади сечения колонны:

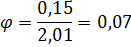
2.8.3 Из уравнения  определяем
определяем 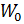 :
:


2.8.4 Для достижения достаточной интенсивности барботажа на тарелке рабочая скорость должна быть больше скорости, соответствующей началу режима равномерной работы колонны.

где  – коэффициент, величина которого приводится (3; с 617);
– коэффициент, величина которого приводится (3; с 617);
Σ – коэффициент сопротивления, приводится (3; с 617);
 – 9,81 м2/с;
– 9,81 м2/с;
 – высота прорези, м;
– высота прорези, м;
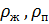 - плотность жидкости, газа, м3/с.
- плотность жидкости, газа, м3/с.


11,57 > 10,05
2.8.5 Гидравлическое сопротивление для барботажных тарелок складывается из сопротивления сухой тарелки и сопротивления столба жидкости на тарелке:

- ∆Р1 определяется по формуле:


- ∆Р2 определяем по формуле:

где: К – отношение плотности парожидкостного слоя к плотности жидкости, принимаем приближенно равным 0,5
П – периметр сливной перегородки.
- ∆h определяем по формуле:


∆Р2 = 1,3 ∙9,81 ∙0,5 ∙782,5 ∙(0,02+0,02/2+0,036 ) = 329,3 Па
∆Р = 692,7 + 329,3 = 959 Па
Проверка правильности принятого расстояния между тарелками


0,45 ≥ 0,22
2.9 Расчет теплового баланса
2.9.1 По диаграмме «t-x-y» определяем температуры кипения жидкостей



По таблицам /3; с 808; 815; 821/ находим значение теплоемкостей (С) и теплот парообразования (Ч) для чистых веществ – НК и ВК:
С (НК) С (ВК)






Ч (НК) C (ВК)
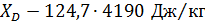

2.9.2 По правилу смешения рассчитываем удельные теплоемкости смесей:

 ,
,
где  удельные теплоемкости чистых веществ
удельные теплоемкости чистых веществ  ;
;
 теплота парообразования чистых веществ, Дж/ кг;
теплота парообразования чистых веществ, Дж/ кг;
 массовые доли НК в исходной смеси, дистилляте, кубовом остатке.
массовые доли НК в исходной смеси, дистилляте, кубовом остатке.




2.9.3 Определяем количество теплоты, отдаваемой охлаждающей воде в дефлегматоре конденсирующими парами:

где  удельная теплота парообразования (конденсации), Дж/кг;
удельная теплота парообразования (конденсации), Дж/кг;
R – флегмовое число;
 расход дистиллята, кг/с.
расход дистиллята, кг/с.
QD = 0,68∙ (1+3,84) ∙ 123,6 ∙ 4190 = 1704459,8 Вт
2.9.4 Определяем количество теплоты, получаемой в кубе-испарителе от греющего пара:

(2, с 171 )
где  расходы дистиллята, кубового остатка и исходной смеси, кг/с;
расходы дистиллята, кубового остатка и исходной смеси, кг/с;
 удельная теплоемкость соответственно дистиллята, кубового остатка и исходной смеси,
удельная теплоемкость соответственно дистиллята, кубового остатка и исходной смеси,  ;
;
 соответствующие температуры, °С;
соответствующие температуры, °С;
 потери тепла, равны 1,03 Вт.
потери тепла, равны 1,03 Вт.
 (0,68∙ (1+3,84)∙ 123,6 + 0,68∙ 0,544∙ 56,5 + 1,6∙ 0,484∙ 79,1 – 2,28∙ 0,495∙67,5)∙ 4190 +1,03 = 1729496,2 Вт
(0,68∙ (1+3,84)∙ 123,6 + 0,68∙ 0,544∙ 56,5 + 1,6∙ 0,484∙ 79,1 – 2,28∙ 0,495∙67,5)∙ 4190 +1,03 = 1729496,2 Вт
2.9.5 Определяем расход греющего пара:

где: Gг.п. – расход греющего пара, кг/с;
QK – расход тепла, Вт;
Чг.п. – теплота конденсации, Дж/кг.
Чг.п. = 510,3 ∙ 4190 Дж/кг (при Рг.п. = 4,0 ат)

2.9.6 Определяем расход воды на конденсацию пара в дефлегматоре:

где QD – расход тепла в дефлегматоре, Вт;
СВ – удельная теплоемкость воды, Дж/ (кг∙°К);
tН, tK – начальная и конечная температура воды, °С.
tH = 25 °C
tK = 25+12 = 37 °C

CB при tcp = 0,998 ∙ 4190 Дж/(кг ∙ °К)

2.10 Определяем диаметр штуцеров

2.10.1 Диаметр штуцера исходной смеси, поступающей в колонну
W= (1,5÷3) м/с
W= 1,5 принимаем
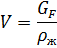
ρж = 782,5 кг/м3
GF =8200/3600 = 2,28 кг/с


d условное = 65 мм
2.10.2 Определяем диаметр штуцера для флегмы, поступающей в колонну:
W= (1,5÷3) м/с
W= 1,5 принимаем
R = 3,84

GR = 0,68 ∙ 3,84 = 2,61 кг/с


d условное = 65 мм
2.10.3 Диаметр штуцера на выходе из колонны паров в дефлегматор:
W= (20÷40) м/с
W= 25 принимаем
Vп = 5140 м3/ч = 1,428 м3/с

d условное = 300 мм
2.10.4 Диаметр штуцера для выхода кубового остатка
W= (0,1÷0,5) м/с
W= 0,3 принимаем
GW = 5757,4 кг/ч = 1,6 кг/с


d условное = 100 мм
Список использованных источников
1. Павлов К. Ф., Романков П. Г., Носков А. А. Примеры и задачи по курсу процессов и аппаратов химической технологии. – С-Пб.: «Химия»,1969
2. Плановский А. Н., Николаев П. И. Процессы и аппараты химической и нефтехимической технологии: Учебник для вузов. – М.: «Химия»,1987
3. Плановский А. Н., Рамм В. М., Каган С. З. Процессы и аппараты химической технологии. – М.: «Химия»,1967
4. Романков П. Г., Курочкина М. И., Мозжерин Ю. А. и др. Процессы и аппараты химической промышленности: Учебник для техникумов. – Л.: «Химия»,1989
5. Флореа О., Смигельский О. Расчеты по процессам и аппаратам химической технологии. – М.: «Химия»,1971
6. Эмирджанов Р.Т., Основы технологических расчетов в нефтепереработке. – М.: «Химия», 1965
7. Иоффе И.Л. Проектирование процессов и аппаратов химической технологии. – М.: Химия, 1991
8. Кувшинский М.Н., Соболева А.П. Курсовое проектирование по предмету процессы и аппараты химической промышленности. – М.: Высшая школа, 1980
9. Дытнерский Ю. И. Основные процессы и аппараты химической технологии. – М.: Химия, 1991
10. Процессы и аппараты химической технологии. Под редакцией А. Захаровой, М.: Академия, 2006
Приложение 1
Министерство образования Саратовской области
Государственное автономное профессиональное образовательное учреждение Саратовской области
«Саратовский областной химико-технологический техникум»
Специальность ____________
шифр
наименование работы
прописными буквами
КУРСОВОЙ ПРОЕКТ
По дисциплине__________________________________________________
Студента ______________________________________________________
______________________________________________________________
фамилия, имя, отчество
Руководитель
_______________________________________________________________
должность подпись, дата фамилия, имя, отчество
Председатель ЦМК
__________________________________________________________________
должность подпись, дата фамилия, имя, отчество
Саратов 20___
Приложение 2
Министерство образования Саратовской области
Государственное автономное профессиональное образовательное учреждение Саратовской области
«Саратовский областной химико-технологический техникум»
Утверждаю:
Руководитель СП
__________________Л.В. Верина «___»_________________2019г.
Задание
на курсовой проект
По специальности__________________________________________________
_______________________________________________________________
Тема___________________________________________________________
полное наименование темы
________________________________________________________________
________________________________________________________________
Студенту ________курса__________________________________________
Руководитель
_______________________________________________________________
должность подпись, дата фамилия, имя, отчество
Председатель ЦМК
__________________________________________________________________
должность подпись, дата фамилия, имя, отчество
Саратов 20___
Приложение 3
Содержание
| Введение Значение нефтеперерабатывающей и нефтехимической промышленности, цель проекта | |
| 1. Общая часть 1.1 Теоретические основы процесса 1.2 Сравнительная характеристика аппаратов для данного процесса, область применения 1.3Техническое обоснование преимуществ выбранного аппарата 1.4 Описание конструкции аппарата, конструкционный материал аппарата 1.5 Сведения по обслуживанию и регулированию аппарата 1.6 Описание схемы блока 1.7 Физико-химические свойства, методы получения продуктов, участвующих в процессе 1.8 Новые литературные сведения по процессу и конструкции аппарата | |
| 2.Специальная часть 2.1 Материальный баланс 2.2 Тепловой баланс 2.3 Технологический расчёт аппарата 2.4 Гидравлический расчёт (элементы) аппарата 2.5 Расчёт диаметров штуцеров | |
| 3.Охрана труда 3.1 Экология (охрана окружающей среды) | |
| Заключение | |
| Список использованных источников Графическая часть Лист1________________________________________________________ наименование и вид документа Лист 2________________________________________________________ наименование и вид документа Приложение 4 Рекомендуемые источники: 1 Дытнерский, Ю.И. Основные процессы и аппараты химической технологии: Пособие по проектированию / Ю.И. Дытнерский –2-е изд . перераб. и доп. – М.: «Химия», 1991. – 491с. |
2 Генкин, А.Е. Оборудование химических заводов: учеб. Пособие для
техникумов / А.Е. Генкин. – 4-е изд. Перераб. и доп. – М.: Высш. шк., 1986. – 280с.
3 Медведева, В.С. Охрана труда и противопожарная защита в химической
промышленности: учебник для техникумов. 2-е изд. Перераб. и доп. / В.С.
Медведева.– М.: Химия, 1989. – 288с.
4 Процессы и аппараты химической технологии учебное пособие для студ./
под редакцией А.А Захаровой. – М.: ACADEMA, 2006. – 517с.
5 Сарданашвили, А.Г. Примеры и задачи по технологии переработки нефти
и газа. /А.Г.Сарданашвили, А.И.Львова. – М.: Химия, 1974. – 272.
6 Гусейнов, Д.А. Технологические расчеты процессов нефтепереработки.
/Д.А. Гусейнов, Ш.Ш. Спектор, Л.З. Вайнер. – М.: Химия, 1964ю – 308с.
Дата выдачи задания _____________________________________________
число, месяц, год
Срок выполнения курсового проекта___________________________________
число, месяц, год
Руководитель
__________________________________________________________________
должность подпись, дата фамилия, имя, отчество
Председатель ЦМК
__________________________________________________________________
должность подпись, дата фамилия, имя, отчество
Приложение 5
ОТЗЫВ
руководителя о качестве проекта студента Структурного подразделения «Отделение нефтегазохимической отрасли»
ГАПОУ СО «Саратовский областной химико-технологический техникум»
________________________________________________________________
фамилия, имя, отчество
специальность___________________________________________________
_______________________________________________________________
Наименование курсового проекта______________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
1. Курсовой проект соответствует заявленной теме____________________
2. Предусмотренные заданием разделы раскрыты в полном объеме, с замечаниями__________________________________________________
__________________________________________________________________________________________________________________________
3. Специальная часть выполнена в полном объеме, с замечаниями_______
__________________________________________________________________________________________________________________________
4. При выполнении курсового проекта студент:
- грамотно применял теоретические знания на практике______________
_____________________________________________________________
- проявил достаточную самостоятельность_________________________
_____________________________________________________________
- проявил умение работать со справочной литературой ______________
_____________________________________________________________
|
из
5.00
|
Обсуждение в статье: Общие сведения о ректификации |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

