 |
Главная |
Тема: Законы термодинамики в приложении к почвообразованию.
|
из
5.00
|
План.
1. Первый закон термодинамикив приложении к почвообразованию.
2. Второй закон термодинамикив приложении к почвообразованию.
3. Третий закон термодинамикив приложении к почвообразованию.
Первый закон термодинамики вытекает из открытого М.В. Ломоносовым и Лавуазье закона сохранения и превращения энергии. Он был полностью разработан в середине прошлого столетия в применении к таким природным явлениям, которые сопровождаются выделением, поглощением или преобразованием теплоты. Закон имеет исключительно большое философское значение, так как выражает неуничтожаемость движения материи.
Поскольку в почвоведении рассматриваются механически неподвижные системы при отсутствии внешнего силового поля, то полная энергия таких систем практически равна их внутренней энергии. Тогда сообщаемая системе теплота Q идет на изменение внутренней энергии системы ΔU=U2—U1 (U1 — внутренняя энергия системы в состоянии 1, U2 — то же, в состоянии 2) и на преодоление сопротивления, препятствующего изменению состояния системы, т. е. на совершение работы А по преодолению воздействия внешних сил. Следовательно,

Эта математическая форма первого закона термодинамики охватывает все как обратимые, так и необратимые процессы.
Для почвоведения наиболее приемлема следующая формулировка первого закона термодинамики: тепло, сообщенное системе, расходуется на увеличение ее внутренней энергии и на совершение системой работы против внешних сил.
Если в системе совершается круговой процесс, то для нее ΔU=0 и A=Q. Это означает, что нельзя представить такую систему, которая совершала бы работу, большую, чем подводимая к ней извне энергия.
Для элементарного изменения состояния системы первый закон термодинамики можно представить в виде дифференциального уравнения
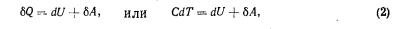
где С — истинная теплоемкость, T — температура системы.
Приведенные уравнения первого закона термодинамики справедливы лишь для систем постоянного веса, т. е. для таких систем, в которых происходит теплообмен с окружающей средой, но отсутствует массообмен. В приложении к почвам данная формулировка требует значительного уточнения, поскольку почвы постоянно осуществляют процесс массообмена, с которым связаны и соответствующие энергетические изменения.
Из практического опыта и теоретических положений почвоведения известно, что почвенные процессы протекают как путем изменения исходного почвообразующего материала на месте, так и путем одновременного поступления и выноса новых масс минеральных и органических соединений под влиянием биологических, геологических и геохимических процессов. Поэтому приложение первого закона термодинамики к пониманию почвенных процессов весьма осложнено многокомпонентностью почвенных систем и сложной, еще мало изученной историей их формирования.
He вдаваясь в подробности математического изложения вопроса и используя опыт смежных наук, можно принять для приближенных расчетов энергетических балансов почв ту форму уравнения, которую предлагают Ю.В. Казицын и В.А. Рудник. для расчета баланса внутренней энергии при формировании метасоматических пород. Хотя метасоматоз и почвообразование различны по своей природе, введение авторами в формулу массообменного фактора позволяет получить уравнение, в котором энергия массообмена учтена и может быть рассчитана:
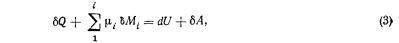
где μi — количество энергии, приносимое с одним молем вещества i; Mi— количество молей вещества i, принесенного в систему.
Используя некоторые дополнительные преобразования и соотношения термодинамики, уравнение (3) можно преобразовать в
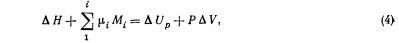
где ΔH — изменение энтальпии2 системы; ΔUp — изменение внутренней энергии в изобарном процессе; P — внешнее давление; ΔV — изменение объема системы.
Выражение (4) представляет собой окончательный вид первого закона термодинамики в применении к почвенным системам; используя его, можно вести приближенный расчет энергетического баланса почв. Согласно этому выражению, сумма энергии, добавленной к почве в результате тепло- и массообмена, равна увеличению ее внутренней энергии плюс произведение давления на изменение объема.
Основным следствием первого закона термодинамики в применении к почвенным системам является то обстоятельство, что при рассмотрении энергетики почв и почвообразовательного процесса невозможно ограничиться учетом только одного энергетического параметра, связанного с поступлением (или отдачей) тепла в систему. Обязательно должен быть учтен и фактор массообмена. Это значит, что, рассматривая энергетику почв, необходимо учитывать не только их взаимодействие с климатом, но и биогеохимические связи (приток и отток вещества).
Поступление энергии в почву в виде тепла — это только один из путей энергообмена почв. Второй стороной почвенной энергетики служит поступление энергии (или ее уход) в процессе биогеохимического массообмена в ландшафте. Отсюда становится понятной ограниченность закона климатической зональности почв и, наоборот, существенная роль геохимических сопряжений почв, что находит отражение в обособлении на земной поверхности почвенно-геохимических формаций и сопряженных почвенно-геохимических ландшафтов. Энергетика почв связана не только с радиацией, но и с биогеохимической аккумуляцией и миграцией веществ.
Второй закон термодинамики был сформулирован Клаузиусом для определения направления термодинамического процесса. Суть этого закона в следующем: теплота сама по себе никогда не переходит от холодного тела к нагретому. Другая формулировка этого закона: невозможен процесс, единственным результатом которого является превращение тепла, полученного от нагревателя, в эквивалентную ему работу, т. е. переход тепла в работу не может являться единственным результатом термодинамического процесса.
Второй закон термодинамики дает возможность разделить все допускаемые первым законом процессы на самопроизвольно и несамопроизвольно протекающие при данных условиях. Он показывает существенное различие двух форм передачи энергии — теплообмена и работы. В отличие от неограниченного перехода работы в теплоту протекание обратного процесса ограничено определенными условиями.
Математическая форма второго закона термодинамики непосредственно связана с введением понятия энтропии S:

Энтропия — это функция состояния системы, дифференциал которой: в элементарном обратимом процессе равен отношению бесконечно малого количества тепла, сообщенного системе, к абсолютной температуре последней. Энтропия является именно той функцией, которая математически выражает одностороннюю направленность протекающих в системе процессов. Поскольку для теплоизолированной (адиабатической) системы δQ=0, то выражение для энтропии принимает вид dS≥0, т. е. энтропия изолированной системы при любых происходящих в ней процессах не может убывать. Энтропия в этом смысле служит мерой необратимости: процессов.
Согласно второму закону термодинамики, при необратимых процессах в изолированной системе энтропия всегда положительна. В открытых системах могут идти процессы как с возрастанием, так и с уменьшением, энтропии.
Третий закон термодинамики (тепловой закон, теорема Нернста), как и первые два, является обобщением эскпериментальных данных и никак не вытекает из первых двух. Введение его оказалось необходимым в связи с тем, что первый и второй законы термодинамики не позволяют определить значение S0 энтропии при абсолютном нуле температуры (Т=0°K) и соответственно не позволяют рассчитать абсолютные значения энтропии, изохорно-изотермного и изобарно-изотермного потенциалов, а также константы равновесия системы. Эта трудность устраняется принципом Нернста, согласно которому в любом изотермическом процессе, проведенном при абсолютном нуле температуры, изменение энтропии системы равно нулю, независимо от изменения любых других параметров состояния, т. е. ΔST=0 и S=S0=const. Отсюда следует, в частности, принцип недостижимости абсолютного нуля температуры. Принцип Нернста был далее развит Планком, предположившим, что при 0°K энтропия системы равна нулю, т. е. S0=0 (T=0). Из этого принципа следует и математическая формулировка третьего закона термодинамики:
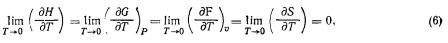
т. е. пределом частных производных энтальпии, свободной энергии и энтропии по температуре является нуль при бесконечном приближении температуры к абсолютному нулю.
Третий закон термодинамики позволяет теоретически рассчитать абсолютные значения термодинамических функций и потому исключительно важен для расчетов состояний систем.
Расчет энергетического состояния таких сложных систем, какой является почва, очень трудоемкий и многоступенчатый. В то же время в почве можно выделить, абстрагировать отдельные энергетические подсистемы, для которых вполне применимы при известных допущениях наиболее общие термодинамические соотношения. К таким подсистемам могут быть отнесены окислительно-восстановительные процессы, гумусообразование, обменные процессы, многие химические реакции, протекающие в почвенном растворе, и т. п. Каждая из таких элементарных систем может исследоваться и самостоятельно, с применением методов и подходок классической термодинамики.
Системой в термодинамическом смысле называют тело или совокупность тел конечных размеров с определенными границами. Почва, как самостоятельное природное тело, в этом смысле является определенной термодинамической системой. Границы этой системы можно рассматривать как в физическом смысле, так и в качестве гипотетических (математических) поверхностей; основным свойством границ почвенной системы является их способность, пропуская через себя в обоих направлениях потоки вещества и энергии, не аккумулировать ни вещество, ни энергию в самих границах.
Реальная почва — это сложная открытая система, находящаяся в постоянном массо- и энергообмене с окружающей средой, поскольку она является компонентом структурной единицы биосферы — биогеоценоза (экосистемы). В то же время в аналитических целях почва может рассматриваться, с соблюдением определенных ограничений, и как замкнутая система, если к ней не применяются параметры, приложимые к открытым системам.
Почва является гетерогенной системой, состоящей из нескольких гомогенных термодинамических систем, имеющих разные свойства. Гомогенной называют систему, для которой характерна непрерывность интенсивных свойств по всему объему. Как известно, интенсивные свойства почвы резко меняются не только при переходе от твердой фазы к жидкой или газообразной, но и при переходе от одного горизонта к другому по почвенному профилю. Например, резкое изменение наблюдается в объемном весе почвы и т. д.
Сложность почвы как термодинамической системы состоит еще и в том, что почва — это многофазная система, если под фазой понимать любое гомогенное тело, которое отличается от ближайшего окружения резким изменением свойств на границах. Этот фактор оказывает исключительно большое влияние на равновесное состояние почвы как гетерогенной системы потому, что термодинамическая характеристика системы непосредственно связана с ее состоянием, а последнее определяется количеством входящих в нее фаз согласно «правилу фаз» Гиббса.
Термодинамическое состояние системы — это состояние ее в данный момент времени. Оно может считаться определенным, если известны все интенсивные свойства системы, т. к. последние зависят только от состояния системы. Любое изменение системы, связанное с изменением хотя бы одного ее свойства, определяется как термодинамический процесс.
Если система, находящаяся в состоянии термодинамического равновесия, испытывает ряд бесконечно малых воздействий со стороны окружающей среды, то в термодинамическом процессе она проходит через бесконечный ряд равновесных состояний; если при этом система совершает и максимальную работу по преодолению внешних воздействий, то такой процесс носит название равновесного процесса. В противоположность этому неравновесный процесс является результатом конечного воздействия окружающей среды на систему. Совершив равновесный процесс, система может вернуться к исходному состоянию, пройдя в обратном процессе те же самые равновесные состояния, которые она проходила и при прямом процессе. Равновесный процесс — это всегда круговой, или обратимый, процесс. Обратимым называют такой термодинамический процесс, который допускает возвращение системы в первоначальное состояние без каких-либо изменений во внешней среде и в самой системе. Если же в результате термодинамического процесса в системе или в окружающей ее среде произойдут какие-либо изменения свойств или хотя бы одного свойства, то такой процесс носит название необратимого. Необратимый процесс всегда одновременно и неравновесный.
Все природные процессы, и в том числе процессы выветривания и почвообразования, являются необратимыми в термодинамическом смысле. Это связано с тем, что природные процессы протекают с конечной скоростью и при конечных разностях между силами, действующими на систему и им противодействующими; они сопровождаются многочисленными неустранимыми потерями в результате наличия трения, лучеиспускания, теплопередачи, диффузии и т. д.
Таким образом, с термодинамической точки зрения почва представляет собой открытую гетерогенную и многофазную систему, характеризуемую необратимыми термодинамическими процессами. Приложение принципов, законов и представлений термодинамики к реальным почвам должно строиться с учетом этого определения.
|
из
5.00
|
Обсуждение в статье: Тема: Законы термодинамики в приложении к почвообразованию. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

