 |
Главная |
СТЕПЕНЬ ДИССОЦИАЦИИ. СИЛА ЭЛЕКТРОЛИТОВ
|
из
5.00
|
СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Распад вещества в растворе или в расплаве на ионы называетсяэлектролитической диссоциацией.
Вещества, распадающиеся в растворах или расплавах на ионы, называются электролитами.
К электролитам относятся вещества, имеющие ионную кристаллическую решетку (большинство солей и оснований), или вещества, состоящие из молекул с полярной связью (кислоты).
Положительно заряженные ионы называются катионами. Отрицательно заряженные ионы называются анионами.
Теорию электролитической диссоциации разрабатывали Аррениус, Д.И. Менделеев, И.А. Каблуков, Нернст, Дебай, Хюккель и другие ученые.
Основные положения теории электролитической диссоциации:
· возможность диссоциации определяется природой растворенного вещества и растворителя;
· электролитической диссоциации подвергаются ионные соединения и молекулярные соединения с полярным типом связи в полярных растворителях;
· вещества распадаются на ионы под действием растворителя;
· диссоциация – процесс обратимый. Наряду с прямым процессом диссоциации, происходит обратный процесс – ассоциация.
· ионы в растворе сольватированы (в водном растворе гидратированы), т. е. окружены оболочкой из молекул растворителя.
Источником энергии, необходимой для разрушения связей в растворяемом веществе, является взаимодействие растворенного вещества с растворителем. В общем случае это взаимодействие называется сольватацией, а если растворителем является вода, то взаимодействие называется гидратацией. Схематически гидратация ионов при растворении NaCl показана на рис. 1.
| – |
| + |
| + - |
| + |
| + |
| + |
| + |
| + |
| – |
| – |
| – |
| – |
| – |
| – |
| + |
| + - |
| - + |
| - + |
| - + |
| - + |
| + |
| – то |
| + |
| – то |
| + |
| – то |
| + |
| – |
| + |
| – |
| ++ |
| + |
| + |
| – |
| – |
| – |
| Cl — |
| + |
| – то |
| – |
| – |
| – |
| – |
| – |
| – |
| – |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| Na+ |
| NaCl |
Рис. 1. Электролитическая диссоциация соли в раствор
В водном растворе ионы гидратированы, т. е. окружены оболочкой из молекул воды. Гидратированные (сольватированные) ионы – это соединения с сильно полярной связью между катионом или анионом, с одной стороны, и окружающей их гидратной (сольватной) оболочкой, с другой стороны.
Иначе протекает диссоциация полярных молекул (рис. 2). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь - дипольное взаимодействие) вызывают расхождение ее полюсов - поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются. При этом ион водорода Н+ (протон) оказывается прочно связанным с молекулой воды в ион гидроксония Н3О+. Так, при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:
HCl + H2O ® H3O+ + Cl-.

Рис. 2. Схема электролитической диссоциации
полярных молекул в растворе.
Теория электролитической диссоциации определяет кислоты, основания и соли по характеру их диссоциации.
Кислоты диссоциируют на катионы водорода (точнее – ионы гидроксония) и анионы кислотного остатка. Одноосновные кислоты диссоциируют в одну ступень, а многоосновные – в несколько ступеней:
Одноосновная кислота HNO3 + H2O ® H3O+ + NO3-,
или в упрощенном виде HNO3 ® H+ + NO3-.
Трёхосновная кислота
1 ступень: H3PO4 Û H+ + H2PO4-
2 ступень: H2PO4- Û H+ + HPO42-
3 ступень: HPO42- Û H+ + PO43-.
Основания диссоциируют на катион металла и анионы ОН-. Однокислотные основания диссоциируют в одну ступень, а многокислотные – в несколько ступеней:
Однокислотное основание КОН ® К+ + ОН-
Двухкислотное основание
1 ступень: Mg(OH)2 ® MgОH+ + ОH-
2 ступень: MgОH+ ® Mg2+ + ОH-
Амфотерные гидроксиды могут диссоциировать как по типу кислоты, так и по типу основания:
Zn2+ + 2OH- Û Zn(OH)2 + 2H2O Û 2H+ + [Zn(OH)4]2-
в кислой среде в щелочной среде
Например, при взаимодействии гидроксида цинка с кислотой протекает реакция:
Zn(OH)2 + 2HCl ® ZnCl2 + 2H2O
При взаимодействии этого же гидроксида со щёлочью будет протекать реакция:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Соли диссоциируют на катионы металла или аммония и анионы кислотного остатка. Средние и двойные соли диссоциируют полностью в одну ступень:
К2SO3 ® 2К+ + SO32-
NН4Сr(SO4)2 ® NН4+ + Cr3+ + 2SO42-
Кислые и основные соли диссоциируют ступенчато:
1 ступень: КHSO3 ® K+ + HSO3-
2 ступень: HSO3- Û H+ + SO32-
1 ступень: CuOHCl ® CuOH+ + Cl-
2 ступень: CuOH+ Û Cu2+ + OH-
СТЕПЕНЬ ДИССОЦИАЦИИ. СИЛА ЭЛЕКТРОЛИТОВ
Все электролиты подразделяются на два типа: сильные и слабые электролиты.
Сильные электролиты в водных растворах распадаются на ионы полностью, и этот процесс практически необратим
HСl ® H+ + Cl-;
Na2SO4® 2Na+ + SO4 2–.
Слабые электролиты диссоциируют на ионы частично
CH3COOH ⇄ CH3COO- + H+.
Для количественной оценки электролитической диссоциации было введено понятие степени электролитической диссоциации a.
Степень электролитической диссоциации – это отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита: a =  , 0 < a < 1.
, 0 < a < 1.
Степень диссоциации выражают в долях единицы или в процентах.
Для слабых электролитов a < 1. Для сильных электролитов предполагают, что a = 1.
Сильные электролиты диссоциируют практически полностью, и этот процесс практически необратим.
К сильным электролитам относят:
· многие растворимые соли (хлорид натрия NaCl, сульфат калия K2SO4, нитрат калия KNO3, хлорид цинка ZnCl2 и др.);
· многие неорганические кислоты (хлороводородная (соляная) HCl, бромоводородная HBr, йодоводородная HI, серная H2SO4, азотная HNO3, хлорная HClО4, хлорноватая HClО3, марганцовая HMnО4, хромовая H2CrО4, дихромовая H2Cr2О7);
· гидроксиды щелочных и щелочноземельных металлов (гидроксид натрия NaOH, гидроксид калия KOH, гидроксид лития LiOH, гидроксид сезия CsOH, гидроксид рубидия RbOH, гидроксид кальция Ca(OH)2, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2).
При растворении слабые электролиты диссоциируют частично и обратимо с установлением равновесия.
К слабым электролитам относятся:
· кислоты (угольная H2CO3, фосфорная Н3РО4, сероводородная H2S, уксусная CH3COOH, борная Н3ВО3, синильная НСN и др.);
· основания (гидроксид аммония NH4OH, гидроксид алюминия Al(OH)3 и др.);
В растворе слабого электролита устанавливается равновесие между недиссоциированными молекулами и диссоциированными ионами. Силами взаимодействия между ионами слабого электролита, как правило, пренебрегают.
Например, уксусная кислота в растворе диссоциирует по уравнению
CH3COOH ⇄ H+ + CH3COOH-.
На основании закона действующих масс константа диссоциации этой реакции запишется:

Константа равновесия К в данном случае называется константой диссоциации. Константа диссоциации представляет собой важную характеристику слабых электролитов. Чем меньше константа диссоциации, тем слабее диссоциирует электролит.
Как уже отмечалось слабые многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Первый ион Н+ или ОН- отрывается от молекулы легче, чем последующие, поэтому константа диссоциации на каждой последующей ступени на несколько порядков ниже, чем на предыдущей ступени.
Для примера рассмотрим ступенчатую диссоциацию фосфорной кислоты и гидроксида цинка.
Первая ступень H3PO4 ⇄ H+ + H2PO4- K1 = 7,53·10-3
Вторая ступень H2PO4- ⇄ H+ + HPO4 2- K2 = 6,31·10-8
Третья ступень HPO42-⇄ H+ + PO4 3- K3 = 1,26·10-12
Первая ступень Zn(ОН)2 ⇄ ZnОН+ + OH- K1 = 4,4·10-5
Вторая ступень ZnOH+ ⇄ Zn(OH)2 + OH- K2 = 1,5·10-9
Сравнивая величины констант диссоциации, видим, что первая ступень диссоциации выражена значительно сильнее, чем последующие. Поэтому в растворах таких веществ в заметных количествах имеются только те ионы, которые образуются по первой ступени диссоциации.
Константа диссоциации, как и любая константа равновесия, зависит от природы диссоциирующего вещества, от температуры, и не зависит от концентрации раствора. С повышением температуры константа диссоциации обычно уменьшается. В соответствии с принципом Ле - Шателье это означает, что процесс диссоциации является экзотермическим, т.е. теплота гидратации ионов выше энергии, затрачиваемой на разрыв внутримолекулярных связей.
Как ранее указывалось, под степенью электролитической диссоциации a понимают отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества.
На примере реакции диссоциации уксусной кислоты рассмотрим, как зависит степень диссоциации слабого электролита от его концентрации в растворе.
Пусть исходного вещества CH3COOH взято 1 моль. На ионы распалась часть моля, равная a , т.е. образовалось ионов
H+ = CH3COO- = a. Осталось не распавшихся молекул 1 – a .
Если объем раствора, в котором растворен 1 моль взятого вещества, равен V, то концентрации будут равны:
 ; [CH3COO—]=
; [CH3COO—]=  ;
;
[CH3COOH]=  .
.
Константа диссоциации будет равна:
K =  ,
,
а т. к.  (концентрация), то
(концентрация), то
K= 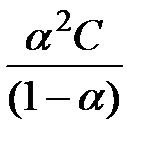 .
.
Если a << 1, то можно считать, что К » a 2 С, т. е.
a »  .
.
Степень диссоциации слабых электролитов зависит от температуры и от концентрации электролита. Это соотношение между константой диссоциации и степенью диссоциации электролита в 1888 г. вывел немецкий ученый Фридрих Оствальд, и называется оно законом разбавленияОствальда.
По з акон у разбавления Оствальда: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
Сильные электролиты диссоциируют в водных растворах нацело, поэтому степень их диссоциации a должна составлять единицу, однако на практике это не наблюдается.
Измерения электропроводности и других величин показывают, что у сильных электролитов a < 1. Например, для хлорида натрия NaCl изотонический коэффициент ί должен быть равен двум, а степень диссоциации - единице. Однако измерения дают величины ί < 2 и a < 1. При сильном разбавлении раствора ί ® 2, a ® 1 (например, ί @ 2при C < 10– 4 моль/л).
При увеличении концентрации раствора сильного электролита за счет незначительных расcтояний между ионами заметно усиливается электростатическое взаимодействие между ними. В таких растворах ионы не вполне свободны, они не могут двигаться совершенно независимо друг от друга. Например, ионы Na+ тормозят перемещение ионов Cl– и обратно, что снижает их активность. Поэтому экспериментально определяемые свойства растворов электролитов средних и высоких концентраций не соответствуют представлениям об их полной диссоциации.
Это явление потребовало ввести для описания свойств растворов электролитов понятие активности (активной концентрации ионов).
Активность связана с концентрацией растворенного вещества соотношением
a = g C,
где a – активность;
g – коэффициент активности (обычно g < 1);
C – молярная концентрация, (моль/л).
Активность - это мера реального поведения вещества в растворе с учетом эффектов взаимодействия ионов между собой и с молекулами растворителя.
Коэффициент активности характеризует степень отклонения свойств данного раствора от свойств идеального раствора. Часто величину g рассматривают как «кажущуюся степень диссоциации» электролита, так как коэффициент активности, как и активность, имеет значения меньше теоретических.
Поскольку g < 1, то a < C, т. е. активность ионов меньше их концентрации и приближается к концентрации только с разбавлением электролита.
Коэффициент активности зависит от концентрации раствора, валентности, радиуса, эффективного заряда ионов, ионной силы раствора и некоторых других факторов.
Следует отметить, что коэффициент активности иона определяется ионной силой раствора. Ионная сила раствора J зависит от заряда z и концентрации С ионов и рассчитывается как полусумма произведений концентраций всех ионов на квадрат их заряда в соответствии с уравнением
J = 0,5 · ( z 1 2 C 1 + z 2 2 C 2 + ¼¼ + z n 2 C n ),
где z1, z2, zn и C1, C2, Cn – заряды и концентрации ионов данного вида.
Для разбавленных растворов зависимость между коэффициентом активности и ионной силой раствора выражается упрощенным уравнением

где g i – коэффициент активности иона;
zi – заряд иона;
J – ионная сила раствора.
Пример 1. Определим ионную силу раствора, содержащего 0,005 моль/л HCl и 0,001 моль/л СаСl2. Рассчитаем активности ионов H+, Cl- , Са2+.
Диссоциация электролитов происходит в соответствии с уравнениями
HCl ® H+ + Cl – ,
СаCl2 ® Са2+ + 2Cl –.
Концентрации С и заряды z ионов равны:
для H+ С1 = 0,005 моль/л, z1 = +1;
для Са2+ С2 = 0,001 моль/л, z1 = +2;
для Cl – С3 = 0,007 моль/л, z1 = –1.
Согласно уравнению получаем величину ионной силы раствора
J = 0,5 · [12·0,005 + 22 · 0,001 + (–1)2 · 0,007] = 0,008
Рассчитываем коэффициенты активности ионов.
 = – 0,5×1×0,089 = – 0,045;
= – 0,5×1×0,089 = – 0,045;  = 0,902;
= 0,902;
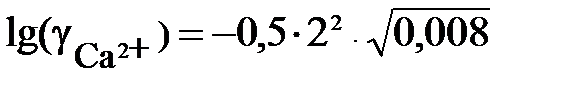 = – 0,5×4×0,089 = – 0,178;
= – 0,5×4×0,089 = – 0,178;  = 0,664
= 0,664
 = – 0,5×1×0,089 = – 0,045;
= – 0,5×1×0,089 = – 0,045;  = 0,902.
= 0,902.
Находим активности ионов.
 ;
;
 ;
;
 .
.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Вода является очень слабым электролитом.
Процесс электролитической диссоциации воды протекает по схеме
Н2О ⇄ Н+ + ОН– , DН = 57,4 кДж/моль.
С учетом гидратации водородного иона, сопровождающейся образованием гидроксоний-иона H3O+, уравнение электролитической диссоциации воды можно записать более строго
2H2O ⇄ H3O+ + OН– .
Процессу электролитической диссоциации воды соответствует константа диссоциации
 .
.
По электрической проводимости экспериментально установлено, что при 22 0С К = 1,8·10 –16. Так как вода диссоциирует в очень малой степени, можно считать, что равновесная концентрация воды [H2O] постоянная величина.
В 1 л воды (1 л @ 1 кг) содержится  55,6 моль воды.
55,6 моль воды.
Уравнение (76) можно представить в форме
[H+] [OH–] = K [H2O] = 1,8 ·10 –16·55,6 = 10 –14
Следовательно, произведение концентраций ионов является при данной температуре постоянной величиной
[H+]·[OH–] = Kв.
Константа Kв называется ионным произведением воды.
Так как в воде концентрации катионов водорода (гидроксония) и гидроксид-анионов равны, то
[H+] = [OH–] =  = 10 – 7 (моль/л)
= 10 – 7 (моль/л)
Растворы, в которых [H+] = [OH–], являются нейтральными. В кислой среде [H+] > 10 –7 моль/л и соответственно [OH– ] < 10 –7 моль/л. В щелочной среде [H+] < 10 –7 моль/л и соответственно [OH–] > 10 –7 моль/л.
На практике для оценки характера среды пользуются концентрацией ионов водорода, причем для удобства берут отрицательный десятичный логарифм концентрации, который обозначается символом рН и называется водородным показателем.
Водородный показатель рН представляет собой десятичный логарифм концентрации ионов водорода, взятый с обратным знаком
рН = – lg [ H + ].
Для нейтрального раствора (при 22оC) pH = 7. В кислой среде
рН < 7, а в щелочной рН > 7 .
Изменение pH раствора от 0 до 6 означает ослабление кислотности; при pH = 7 раствор нейтральный; при изменении pH от
7 до 14 происходит усиление щелочности раствора.
Измерение концентрации водородных ионов ведут колориметрическим методом или методом, основанным на измерении электродвижущих сил (ЭДС). Последний метод наиболее точен и применим к любым растворам (окрашенным и непрозрачным).
Колориметрический, или индикаторный, метод требует прозрачных окрашенных растворов и является менее точным. Он позволяет определить pH растворов от целых до десятых долей единицы. Индикаторный метод основан на сравнении изменяющейся окраски индикатора в определенных интервалах pH.
|
из
5.00
|
Обсуждение в статье: СТЕПЕНЬ ДИССОЦИАЦИИ. СИЛА ЭЛЕКТРОЛИТОВ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

