 |
Главная |
Электролиз расплавов и растворов
|
из
5.00
|
Электролизом называют процессы, протекающие под действием электрического тока на электродах, погруженных в расплав или раствор электролита. При электролизе происходит превращение электрической энергии в химическую.
При электролизе расплава соли или щелочи на катоде всегда восстанавливаются катионы металла, а на аноде окисляются анионы кислотного остатка (электролиз расплавов солей) или гидроксид – анионы (электролиз расплавов щелочей).
Пример Составьте электронные уравнения процессов, происходящих на электродах при электролизе расплава щелочи гидроксида натрия.
Решение При плавлении происходит термическая диссоциация щелочи:
NaOH ® Na+ + OH-
Под действием электрического тока происходит направленное движение ионов. На катоде будет идти восстановление катионов Na+, на аноде – окисление гидроксид – анионов:
(-) Катод Na+ OH- ® Анод (+)
Na+ + 1e ® Na 4ОН- - 4е ® 2Н2О + О2
Суммарное уравнение:
Na+ + 1ē ® Na 4
4ОН- - 4ē ® 2Н2О + О2 1
4Na+ + 4OH- ® 4Na + 2H2O + O2
Молекулярное уравнение:
4NaOH  4Na + O2 + 2H2O
4Na + O2 + 2H2O
В водных растворах электролитов находятся гидратированные ионы растворенного вещества и молекулы воды. При электролизе растворов наряду с процессами восстановления катионов и окисления анионов могут восстанавливаться или окисляться и молекулы воды.
На катоде протекает процесс восстановления. В первую очередь будут восстанавливаться наиболее сильные окислители с наибольшим положительным потенциалом. В зависимости от величин стандартных электродных потенциалов металлов возможны три варианта катодного процесса при электролизе.
1.Если соль образована катионами металлов, расположенными в раду стандартных электродных потенциалов от Li+ до Al3+ включительно, потенциал которых более электроотрицателен по сравнению с потенциалом восстановления молекул воды (-0,41 В). Поэтому на катоде происходит электрохимическое восстановление молекул воды с выделением водорода:
2Н2О + 2ē ® Н2 + 2ОН-
2.Если соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после водорода, потенциал которых более положителен по сравнению с потенциалом восстановления воды, то на катоде восстанавливаются катионы металла:
Меn+ + nē ® Ме
3.Если соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после Al3+ до водорода, потенциалы которых мало отличаются от потенциала восстановления воды, то на катоде восстанавливаются катионы металлов одновременно с молекулами воды:
Меn+ + nē ® Ме
2Н2О + 2ē ® Н2 + 2ОН-
На аноде протекает процесс окисления. Характер реакций, протекающих на аноде, зависит от природы электролита, присутствия молекул воды и материала анода. Аноды подразделяются на нерастворимые и растворимые.
Сначала на аноде окисляются наиболее сильные восстановители – ионы, имеющие наименее положительный потенциал.
В случае нерастворимых (инертных) анодов возможны два варианта анодного процесса при электролизе.
1.Если соль образована бескислородной кислотой (кроме фторидов), то на аноде окисляются анионы этих кислот, например:
2J- - 2ē ® J2
или S2- - 2ē ® S
2.Если соль образована кислородсодержащей кислотой, а также фтороводородной кислоты и фторидов, то на аноде окисляются молекулы воды с выделением О2:
2Н2О – 4ē ® О2 + 4Н+
Если электролизу подвергается раствор щелочи, то на аноде будут окисляться гидроксид – ионы:
4ОН- - 4ē ® О2 + 2Н2О
В случае растворимых (активных) анодов сам анод подвергается окислению:
Ме Û Меn+ + nē
металл уходят уходят
анода в раствор во внешнюю цепь
Образующиеся катионы переходят в раствор, анод при этом растворяется.
Пример. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора хлорида натрия NaCl с нерастворимым анодом.
Решение. Натрий располагается в начале ряда стандартных электродных потенциалов до алюминия, на катоде будут восстанавливаться молекулы воды. На аноде будут окисляться хлорид – ионы, так как это анионы бескислородной кислоты:
NaCl ® Na+ + Cl-
(-) Катод Na+ Cl- ® Анод (+)
Н2О
2Н2О + 2ē ® Н2 + 2ОН- 2Cl- -2ē ® Cl2
Суммарное уравнение:
2Н2О + 2ē ® Н2 + 2ОН-
2Cl- -2ē ® Cl2
2Н2О + 2Cl- ® Н2 + 2ОН- + Cl2
В прикатодном пространстве накапливаются катионы Na+ и анионы ОН-, образуя щелочь NaOH.
Молекулярное уравнение:
2NaCl + 2H2O 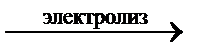 H2 + Cl2 + 2NaOH
H2 + Cl2 + 2NaOH
катод анод в прикатодном
пространстве
Пример. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Ag 2 SO 4.
Решение. Серебро располагается в ряду стандартных электродных потенциалов после водорода, следовательно, на катоде будет идти восстановление катионов серебра. На аноде идет окисление молекул воды с выделением кислорода, т.к. соль образована кислородосодержащей кислотой.
Ag2SO4 ® 2 Ag+ + SO42-
(-) Катод Ag+ SO42- ® Анод (+)
Н2О
Ag+ + 1ē ® Ag 2H2O - 4ē ® O2 + 4H+
В прианодном пространстве накапливаются ионы SO42- и Н+, образуя кислоту Н2SO4.
Суммарное уравнение:
Ag+ + 1ē = Ag 4
2H2O - 4ē = O2 + 4H+ 1
4Ag+ + 2H2O = 4Ag + O2 + 4H+
или
2Ag2SO4 + 2Н2О 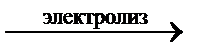 4Ag + О2 + 2Н2SO4
4Ag + О2 + 2Н2SO4
катод анод в прианодном
пространстве
Пример. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Ni ( NO 3 )2.
Решение. Никель располагается в ряду стандартных электродных потенциалов после алюминия, но до водорода. На катоде будет происходить восстановление катионов никеля, а также молекул воды с выделением водорода. На аноде идет окисление молекул воды с выделением кислорода.
Ni(NO3)2 ® Ni2+ + 2NO3-
(-) Катод Ni2+ 2NO3- ® Анод (+)
Н2О
Ni2+ + 2ē ® Ni0
2Н2О + 2ē ® Н20 + 2ОН- 2Н2О - 4ē ® О2 + 4Н+
В прианодном пространстве накапливаются ионы NO3- и Н+, образуя кислоту НNO3.
Суммарное уравнение
Ni2+ + 2ē ® Ni0
2Н2О + 2ē ® Н20 + 2ОН-
2Н2О - 4ē ® О2 + 4Н+ ® 2Н2О + 2Н+
Ni2+ +2Н2О = Ni + Н2 + О2 + 2Н+
или
Ni(NO3)2 + 2Н2О 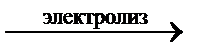 Ni + Н2 + О2 + 2НNO3
Ni + Н2 + О2 + 2НNO3
катод анод в прианодном
пространстве
Пример. Электролиз водного раствора BiCl 3 на активных электродах (анод висмутовый).
Решение.
BiCl3 ® Bi3+ + 3Cl-
(-) Катод Bi3+ 3Cl- ® Анод (+)
висмутовый
Bi3+ + 3ē ® Bi0 Bi0 - 3ē ® Bi3+
Процесс будет продолжаться до полного растворения анода.
Количественная сторона электролиза основывается на законах Фарадея: количество вещества, окисленного на аноде или восстановленного на катоде, пропорционально количеству прошедшего через раствор или расплав электричества.
Масса выделившихся на электродах веществ (m) определяется по формуле:
 ,
,
где Мэ – молярная масса эквивалента вещества, г/моль;
J – сила тока, А;
t - продолжительность электролиза, с;
F – число Фарадея (96500 Кл).
Пример. Наиболее технологичным и эффективным способом выделения металлов из растворов является электролиз. Если годовой объем очищаемой воды равен 1000 м3 ,а содержание в нем ионов Сr3+ составляет 12,4 мг/дм3, определить время необходимое для выделения всего хрома электролизом при силе тока 19,97 А и выходе по току 100 % в сутках ( Ar (Cr) = 52).
Решение. Для вычисления времени электролиза используем математическое выражение законов Фарадея:
 .
.
Молярная масса эквивалента хрома (3+) равна отношению молярной массы хрома к его валентности: Мэ(Cr) = 52/3 = 17,33 г/моль.
С (Сr3+) = 12,4 мг/дм3 = 12,4 · 10-3 г/л
1 м3 = 106 л
m (Сr3+) = 12,4 · 10-3 г/л · 106 л = = 12,4 · 103 г
Продолжительность электролиза:

Переводим секунды в сутки:
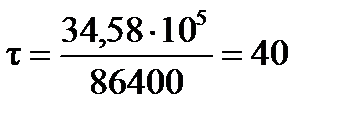 суток
суток
Коррозия металлов
Коррозия - это самопроизвольное разрушение металлов и сплавов в результате физико-химического взаимодействия их с окружающей средой. Коррозия представляет собой окислительно-восстановительный процесс, протекающий на границе раздела фаз. Ме в этих случаях окисляются, а вещества, с которыми они взаимодействуют, восстанавливаются.
1) Виды коррозии по характеру разрушения:
- сплошная (общая коррозия) - охватывает всю поверхность металла, которая находится под воздействием коррозионной среды; сплошная коррозия подразделяется на: равномерную, неравномерную и избирательную.
- местная - распространяется лишь на некоторых участках поверхности металла.
- интеркристаллитная – коррозия продвигается вглубь по границам зерен Ме
- транскристаллитная – рассекает Ме трещиной через зерна
- избирательная – в сплаве разрушается один компонент
2) По механизму протекания коррозионного разрушения различают химическую и электрохимическую коррозию.
Химическая коррозия
- это разрушение Ме окислением его в окружающей среде без возникновения электрического тока в системе. В этом случае происходит взаимодействие Ме с газами и неэлектролитами.
По условиям протекания коррозионного процесса различают газовую коррозию и коррозию в неэлектролитах.
Газовая коррозия протекает в сухих газах или парах без конденсации влаги на поверхности Ме при высоких температурах (окисление Ме кислородом воздуха).
Коррозия в неэлектролитах – агрессивных органических жидкостях (сернистая нефть). Примером может служить разрушение цилиндров внутреннего сгорания в жидком топливе. В топливе содержатся примеси – сера и ее соединения, которые при сгорании превращаются в оксиды серы ( IV ) и ( VI ) – коррозионно-активные вещества. Они разрушают элементы реактивных двигателей.
|
из
5.00
|
Обсуждение в статье: Электролиз расплавов и растворов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

