 |
Главная |
Метод электрокоагуляции
|
из
5.00
|
Метод наиболее пригоден для выделения хрома. Сущность метода заключается в восстановлении Cr(VI) до Cr(III) в процессе электролиза с использованием растворимых стальных электродов. При прохождении растворов через межэлектродное пространство происходит электролиз воды, поляризация частиц, электрофорез, окислительно-восстановительные процессы, взаимодействие продуктов электролиза друг с другом.
Суть протекающих при этом процессов заключается в
следующем: при протекании постоянного электрического тока через хромсодержащие растворы гальваношламов, анод подвергается электролитическому растворению с образованием ионов Fe, которые, с одной стороны, являются эффективными восстановителями для ионов хрома (VI), с другой - коагулянтами:
 Cr 2O7 2- + 6Fe 2+ 6Fe 2+ + 2Cr3+
Cr 2O7 2- + 6Fe 2+ 6Fe 2+ + 2Cr3+
На катоде выделяется газообразный водород, что ведет к
выщелачиванию раствора и созданию таким образом условий для выделения гидроксидов примесных металлов, также происходит процесс электрохимического восстановления по реакциям:
 2H + + 2e H2
2H + + 2e H2
 Cr2O7 2- + 14H + 2Cr 3+ + 7H2O
Cr2O7 2- + 14H + 2Cr 3+ + 7H2O
Находящиеся в растворе ионы Fe +3, Fe 2+ ,Cr+3 гидратируют с образованием гидроксидов Fe(OH)3 ,Fe(OH)2 ,Cr(OH)3. Образующиеся гидроксиды железа являются хорошими коллекторами для осаждения гидроксидов примесных металлов и адсорбентами для других металлов.
Электрокоагуляторы внедрены на ряде предприятий. Разработчики: электрокоагуляционная установка (ЦНТИ, Петропавловск-Камчатский); установка “Лоста” (НИЦ “Потенциал”, Ровно); напорный электрокоагулятор “Эко” (трест “Цветводоочистка”, Екатеринбург); электрокоагулятор (НИИ “Стрела”, Тула); электрокоагулятор (ЦНИИСТ, Севастополь),ОАО “Диод” (Владимир) и др.
Электрокоагуляционная установка на ОАО “Диод” состоит из трехсекционной гальванической ванны, выпрямителя ВАКР-1600-12У4 и промежуточной емкости с двумя насосами для откачки обезвреженных стоков на отстойник. По мере пропускания постоянного тока через сточные воды в электролизной ванне в железными электродами происходит анодое растворение электродов, образующиеся при этом ионы 2-х валентного железа восстанавливают ионы хрома шестивалентного до трехвалентного. Одновременно происходит гидролиз ионов железа и вторичных соединений с образованием нерастворимых гидроксидов Fe(OH)2,Fe(OH)3 ,Cr(OH)3 и др. Процесс является неперерывным, под напряжением 12В и плотности тока 0.5 – 1 А/дм2. Фильтрация сточной воды производится на нутч-фильтре.
Достоинства метода
1) Очистка до требований ПДК от соединений Cr (VI).
2) Высокая производительность.
3) Простота эксплуатации.
4) Малые занимаемые площади.
5) Малая чувствительность к изменениям параметров
процесса.
6) Получение шлама с хорошими структурно-механическими
свойствами.
Недостатки метода
1) Не достигается ПДК при сбросе в водоемы рыбохозяйственного назначения.
2) Значительный расход электроэнергии.
3) Значительный расход металлических растворимых
анодов.
4) Пассивация анодов.
5) Невозможность извлечения из шлама тяжелых
металлов из-за высокого содержания железа.
6) Невозможность возврата воды в оборотный цикл
из-за повышенного солесодержания.
7) Потребность в значительных площадях для шламоотвалов.
8) Необходимость предварительного разбавления стоков до
суммарной концентрации ионов тяжелых металлов 100 мг/л.
Электролиз. (окисление)
В процессах электрохимическое окисление протекает на положительном электроде - аноде, которому ионы отдают электроны. Вещества, находящиеся в сточных водах, полностью распадаются с образованием более простых и нетоксичных веществ, которые можно удалять другими методами. В качестве анодов используют различные электрически нерастворимые вещества: графит, магнетит, диоксиды свинца, марганца и рутения, которые наносят на титановую основу. Катоды изготавливают из молибдена, сплава железа с вольфрамом, сплава вольфрама с никелем, из графита, нержавеющей стали и других металлов, покрытых молибденом, вольфрамом или их сплавами. Метод используется на многих предприятиях.
Применению электролиза до последнего времени препятствовала низкая производительность аппаратов с плоскими электродами. Перспективы решения этой проблемы открылись с разработкой и внедрением в практику достаточно простых и надежных электролизеров с проточными объемно-пористыми волокнистыми электродами. Они позволяют ускорить процесс извлечения металлов более чем в 100 раз за счет высокой удельной поверхности и повышенного коэффициента массопередачи (до 0.05 – 0.1 м3/с). Применяются и другие типы аппаратов с развитой электродной поверхностью, например псевдоожиженного типа, разрабатываемые в Киеве и Санкт-Петербурге.
Работы в этом направлении также требуют дальнейшего развития: поиск путей увеличения доступной электролизу внутренней поверхности электродов; оптимизация стадии регенерации осажденного металла и анодных процессов; разработка более компактных, дешевых и экономичных электролизеров, а также стойких и дешевых анодных материалов.
Разработаны электролизеры типа Э-ЭУК, Е-91А, ЭПУ (ВПТИЭМП), модуль - МОПВ (НИТИАП, Нижний Новгород), регенераторы (ЦМИ “Контакт”, Пермь).
В США разработана конструкция электролизера для извлечения тяжелых металлов, в котором однородный поток мельчайших пузырьков воздуха, направленный перпендикулярно поверхности катода, разрушает примыкающий к катоду диффузный слой электролита. Это резко улучшает массообмен в электролите и повышает выход по току. Также в США широко используется электролизер, оборудованный биполярными электродами из углеродистой стали. Расход электроэнергии составляет 10 кВт на 1 кг тяжелых металлов. При содержании тяжелых металлов более 50 мг/л электрохимическая обработка осуществляется в несколько стадий. Концентрация вредных примесей тяжелых металлов после очистки не превышает по каждому из них 0.05 мг/л.
В Днепропетровском химико-технологическом институте предложено сточные воды обрабатывать в электролизере с растворимым анодом из пористого титана в присутствии замещенного амида иминосульфиновой кислоты формулы C6H5S(=NSO2C6H5)NHSO2C6H5.Размеры пор пористого титана 20 – 300 мкм, общая пористость 20 – 40 % .
Приведена схема одноступенчатой электролитической установки для удаления тяжелых металлов (удаление 90% металлических ионов) из сточных вод. В бездиафрагменном электролизере используются 2 насыпных катода, между которыми расположен пластинчатый анод. Катод состоит из гранул, изготовленных из материала, который плохо сцепляется с осаждаемыми металлами и поэтому осаждаемый металл выпадает на дно в виде порошка.
Достоинства метода
1) Отсутствие шлама.
2) Незначительный расход реагентов.
3) Простота эксплуатации.
4) Малые площади, занимаемые оборудованием.
5) Возможность извлечения металлов из концентрированных
стоков.
Недостатки метода
1) Не обеспечивает достижение ПДК при сбросе в водоемы рыбохозяйственного назначения.
2) Аноды из дефицитного материала.
3) Неэкономичность очистки разбавленных стоков
Метод гальванокоагуляции
Метод внедрен на ряде предприятий. Разработчики: “Гипроцветметобработка”, “Казмеханобр”. Изготовители: Востокмашзавод (Усть-Каменогорск), Бердичевский машиностроительный завод и др.
На предприятии “Казмеханобр” испытан
гальванокоагуляционный аппарат типа КБ-1 производительностью 50-100 м3 /сут для очистки сточных вод.
Достоинства метода
1) Очистка до требований ПДК от соединений Cr(VI).
2) В качестве реагента используются отходы железа.
3) Малая энергоемкость.
4) Низкие эксплуатационные затраты.
5) Значительное снижение концентрации сульфат-ионов.
6) Высокая скорость процесса
Недостатки метода
1) Не достигается ПДК при сбросе в водоемы рыбохозяйственного назначения.
2) Высокая трудоемкость при смене загрузки.
3) Необходимость больших избытков реагента (железа).
4) Большие количества осадка и сложность его
При электроокислении сточные воды пропускаются через электролизер, в котором происходит электрохимическое окисление органических примесей на нерастворимом аноде. Например, фенол окисляется на аноде до оксида углерода и малеиновой кислоты:
С6Н5ОН + 7Н2О - 16е = 2СО2 + (СНСООН)2 + 16Н+
Метод электрохимического восстановления с применением нерастворимых электродов особенно эффективен для обезвреживания хромсодержащих сточных вод с большими концентрациями Cr6+ (более 2 г/литр). Катодное восстановление металлов происходит по схеме:
Men +ne- → Me0
При этом металлы осаждаются на катоде и могут быть рекуперированы. При использовании метода электрохимического восстановления можно снизит концентрацию хрома в сточных водах на 3 порядка.
Наиболее широко для выделения металлов из промышленных сточных вод применяются следующие виды катодов:
Пористые, объемно-насыпные проточные, плоские пластины с инертной загрузкой
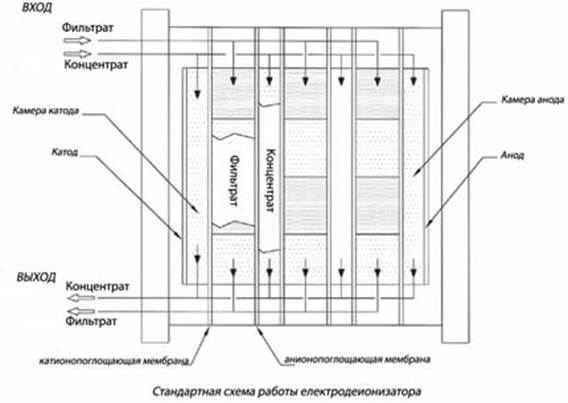
Электродиализ.
Процесс удаления из раствора ионов растворённых веществ путём избирательного их переноса через мембраны, селективные к этим ионам, в поле постоянного тока. Движущей силой процесса является градиент электрического потенциала.

На фото – установка.
 При наложении постоянного эл. поля на р-р возникает направленное движение ионов солей и Н+ и ОН- . Катионы к катоду, анионы к аноду. Если р-р разделить на секции с помощью спец. мембран, проницаемых только для катионов или только для анионов, то катионы, например, будут свободно будут свободно проходить через эту катионитовую мембрану, т.о. р-р разделится на Н2О и концентрированные р-ры. При использовании проницаемых для ионов неселективных мембран можно разделять электролиты и неэлектролиты.
При наложении постоянного эл. поля на р-р возникает направленное движение ионов солей и Н+ и ОН- . Катионы к катоду, анионы к аноду. Если р-р разделить на секции с помощью спец. мембран, проницаемых только для катионов или только для анионов, то катионы, например, будут свободно будут свободно проходить через эту катионитовую мембрану, т.о. р-р разделится на Н2О и концентрированные р-ры. При использовании проницаемых для ионов неселективных мембран можно разделять электролиты и неэлектролиты.
Матрица анионообменной мембраны имеет катионные группы. Заряд катионов нейтрализован зарядом подвижных анионов, находящихся в порах мембраны. Анионы раствора электролита могут внедряться в матрицу мембраны и замещать первоначально присутствующие в ней анионы. Проникновению в мембрану катионов препятствуют силы отталкивания их фиксированными в матрице мембраны катионами.
На электродах протекает процесс электролиза. В многокамерном аппарате неизбежные непроизводительные затраты электроэнергии, обусловленные этим процессом, распределяются на большое число камер. Поэтому в расчете на единицу продукции эти затраты сводятся к минимуму.

Процесс электродиализа реже применяется в промышленности, чем процессы обратного осмоса и ультрафильтрации, так как применяя электродиализ возможно удалять из раствора только ионы. Наиболее широко электродиализные установки применяются для опреснения морской воды при получении питьевой и/или технической воды. Но чаще процесс электродиализа применяют для очистки воды, содержание растворенных солей в которой составляет примерно 10 г/л. В этом случае процесс электродиализа является более экономичным по сравнению с обратным осмосом или выпариванием. При помощи электродиализа можно получать растворы солей со сравнительно высокой концентрацией. Благодаря этой особенности рассматриваемого процесса электродиализ применяется также при производстве поваренной соли и других солей из морской воды. Электродиализ применяется также для предочистки воды для теплоэнергетических установок.
Применяется для обессоливания сточных вод гальванического производств (гальванических стоков). Также мембранный электролиз используется для концентрирования сточных вод, содержащих ценные компоненты (например, драгоценные металлы), перед последующим извлечением этих компонентов. По сравнению с обратным осмосом электродиализ имеет то преимущество, что позволяет использовать термически и химически более стойкие мембраны, поэтому процесс электродиализа может осуществляться при повышенных температурах, а также при очень малых или наоборот больших значениях pH раствора. Ограничением в применении электродиализа для очистки стоков гальванического производства является невозможность удалить незаряженные компоненты, которые также присутствуют в сточных водах.
Общая схема:
Выводы.
В результате анализа научно-технической и патентной литературы становится очевидно, что не существует универсального, т.е. эффективного и дешевого метода очистки промышленных сточных вод.
Наиболее широко применяемый реагентный метод, достаточно прост и дешев, однако не решает проблему утилизации ценных компонентов, которые безвозвратно теряются с осадками. В результате чего почвы загрязняются токсичными шламами. Кроме того, метод не обеспечивает необходимого качества очистки сточных вод, предполагая направлять стоки на доочистку в городской коллектор, причиняя немалый ущерб окружающей среде и подрывая бюджет предприятия.
ХПК и БПК.
ХПК – 1) выражает количество кислорода, необходимое для полного химического окисления органических веществ загрязнений в СВ, мг/л. «Сhemical oxyden demand» (COD) Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК. При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК).
БПК – количество кислорода в миллиграммах, требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях, без доступа света, при 20°С, за определенный период в результате протекающих в воде биохимических процессов.
БПК - количество кислорода, необходимое для окисления органических веществ в естественных условиях до полной их минерализации.


Особенностью биохимического окисления органических веществ в воде является сопутствующий ему процесс нитрификации, искажающий характер потребления кислорода
Нитрификация протекает под воздействием особых нитрифицирующих бактерий – Nitrozomonas, Nitrobacter и др. Эти бактерии обеспечивают окисление азотсодержащих соединений, которые обычно присутствуют в загрязненных природных и некоторых сточных водах, и тем самым способствуют превращению азота сначала из аммонийной в нитритную, а затем и нитратную формы. Соответствующие процессы описываются уравнениями:

где: Q – энергия, высвобождающаяся при реакциях.
Рекомендуемые реагенты при реагентной очистке и количества:
| Доза реагента, мг/л | ||||||||
| Сточные воды | Загрязняющие вещества | Концентрация загряз- няющих веществ, мг/л | Реагенты | извес-ти | солей алюми- ния | солей железа | анионного флокулянта по активному полимеру | катионного флокулянта по активному полимеру |
| Нефтеперерабаты- вающих заводов, | Нефтепро- дукты | До 100 | Соли Al совместно | - | 50-75 | - | 0,5 | 2,5-5 |
| нефтеперевалоч- | 100-200 | с анионным | - | 75-100 | - | 1,0 | 5-10 | |
| ных баз | 200-300 | флокулянтом или без, катионные флокулянты | - | 100-150 | - | 1,5 | 10-15 | |
| Машиностроитель- ных, коксохими- ческих заводов | Масла | До 600 | Соли Al или Fe с анионным флоку- лянтом или без, катионные флокулянты | - | 50-300 | 50-300 | 0,5-2 | 5-20 |
| Пищевой промыш- | Эмульсии | 100 | Соли Al | - | 150 | 150 | - | - |
| ленности, шерсто- мойных фабрик, | масел и жиров | 300 | или Fe совместно | - | 300 | 300 | 0,5-3 | - |
| заводов металло- обрабатывающих, | 500 | с анионным флокулянтом | - | 500 | 500 | 0,5-3 | - | |
| синтетических во- локон | 1000 | или без него | - | 700 | 700 | 0,5-3 | - | |
| Целлюлозно-бу- | Цветность | 950 | То же | - | 250 | 250 | - | - |
| мажной промыш- | (сульфатный | 1450 | - | 275 | 275 | - | - | |
| ленности | лигнин), | 2250 | - | 400-500 | 400-500 | - | - | |
| град ПКШ | ||||||||
| Цветность | 1000 | Известь СаО | 1000 | - | - | - | - | |
| (лигносуль- | 2000 | 2500 | - | - | - | - | ||
| фат), | ||||||||
| град ПКШ | ||||||||
| Шламовые воды | Суспензия | До 100 | Анионный флоку- | - | - | - | 2-5 | - |
| углеобогатитель- | угольных | 100-500 | лянт | - | - | - | 5-10 | - |
| ных фабрик, шахт- | частиц | 500-1000 | - | - | - | 10-15 | - | |
| ные воды | 1000-2000 | - | - | - | 15-25 | - | ||
| Бумажных и кар- тонных фабрик | Суспензия целлюлозы | До 1000 | Соли Al совместно | - | 50-300 | - | 0,5-2 | - |
| с анионным флокулянтом | ||||||||
| Катионный флоку- лянт | - | - | - | - | 2,5-20 | |||
| Городские и бы- | БПКполн | До 300 | Соли Al | - | 30-40* | - | 0,5-1,0 | - |
| товые | совместно с анионным флокулянтом или без него | - | 40-50* | - | - | - | ||
| Взвешенные | До 350 | Соли железа | - | - | 40-50** | 0,5-1,0 | - | |
| вещества | совместно с анионным флокулянтом | - | - | 100-150*** | 0,5-1,0 | - | ||
| или без него | - | - | 50-70*** | - | - | |||
| Катионный флоку- лянт | - | - | - | - | 10-20 | |||
П р и м е ч а н и е. Дозы реагентов приведены по товарному продукту, флокулянтов - по активному полимеру, за исключением: * - по Аl2О3, ** - по FeSO4, *** - по FeCl3.
|
из
5.00
|
Обсуждение в статье: Метод электрокоагуляции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

