 |
Главная |
Расчет материального баланса установки
|
из
5.00
|
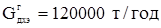
Производительность установки с учетом потерь
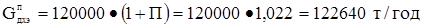
Рассчитываем часовую производительность установки
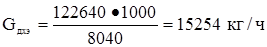
С учетом состава технического ДХЭ
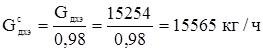
В реакторе протекают следующие реакции:
1. Образование 1,2 – дихлорэтана.
 С2Н4 + 2Cl2 C2H4Cl2
С2Н4 + 2Cl2 C2H4Cl2
2. Образование 1,1,2 – трихлорэтана
 С2Н4 + Cl2 C2H3Cl3 + HCl
С2Н4 + Cl2 C2H3Cl3 + HCl
3. Образование винилхлорида
 С2H4 + Cl2 C2H3Cl + HCl
С2H4 + Cl2 C2H3Cl + HCl
4. Образование хлористого этила
 C2H4 + HCl C2H5Cl
C2H4 + HCl C2H5Cl
При этом образуется:
ДХЭ – 15565 • 0,98 = 15254 кг/ч
ТХЭ – 15565 • 0,02 = 311,3 кг/ч
ВХ – 15565 • 0,1/100 = 15,56 кг/ч
ХЭ – 15565 • 0,1/100 = 15,56 кг/ч
Определение количества хлора и этилена, идущих на образование ДХЭ – сырца.
На образование ДХЭ (100%-ого):
X1 X2 15254
 CH2=CH2 + Cl2 C2H4Cl2
CH2=CH2 + Cl2 C2H4Cl2
28 71 99
М (С2Н4) = 28 кг/кмоль
М (Сl2) = 71 кг/кмоль
М (С2Н4Cl2) = 99 кг/кмоль
X1 (C2H4) = 28•15254/99 = 4402,2 кг/ч
Х2 (Сl2) = 71•15254/99 = 10939,7 кг/ч
На образование ТХЭ:
Х1 Х2 311,3 Х3
 С2Н4 + 2Cl2 С2Н3Cl3 + НCl
С2Н4 + 2Cl2 С2Н3Cl3 + НCl
28 142 133,5 36,5
M(HCl) = 36,5 кг/кмоль
М(С2H3Cl3) = 133,5 кг/кмоль
Х1 (С2Н4) = 28•∙311,3/133,5 = 65,3 кг/кмоль
Х2 (Cl2) = 142•311,3/133,5 = 331,2 кг/кмоль
Х3(НCl) = 65,3•36,5/28 = 85,1 кг/ч
На образование ВХ:
Х1 X2 15,56 X3
 С2H4 + Сl2 C2H3Cl + HCl
С2H4 + Сl2 C2H3Cl + HCl
28 71 62,5 36,5
M(C2H3Cl) = 62,5 кг/кмоль
Х1(C2H4) = 28•15,56/62,5 = 6,97 кг/ч
Х2 (Сl2) = 71•15,56/62,5 = 17,27 кг/ч
Х3(НCl) = 6,97•36,5/28 = 9,1 кг/ч
На образование ХЭ:
Х1 X3 15,56
 С2Н4 + НCl C2H5Сl
С2Н4 + НCl C2H5Сl
28 36,5 64,5
M(C2H5Cl) = 64,5 кг/кмоль
Х1(С2Н4) =28•15,56/64,5 = 6,7 кг/ч
В данном случае идет утилизация хлористого водорода, образовавшегося в предыдущих реакциях.
Х3 (HCl) = 15,56•36,5/64,5=8,8 кг/ч
Определяем суммарное количество образовавшегося хлористого водорода:
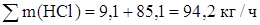
На реакцию образования этилхлорида расходуется хлористого водорода – 10,1 кг/ч. остальное количество 94,2 – 8,8 = 85,4 кг/ч растворяется в дихлорэтане сырце.
Общий расход этилена.
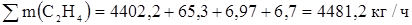
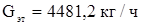
Расход технического этилена.
Состав технического этилена, % об.:
Этилен (С2Н4) – 99,9
Метан (СН4) – 0,048
Этан (С2Н6) – 0,048
Пропилен (С3Н6) – 0,005
Плотность при нормальных условиях [5]
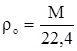
где М – молекулярная масса газа, кг/кмоль
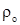 – плотность газа при н.у., кг/м3
– плотность газа при н.у., кг/м3
22,4 м3 – объем, занимаемый 1 кмоль газа.
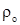 (С2Н4) = 28/22,4 = 1,250 кг/м3
(С2Н4) = 28/22,4 = 1,250 кг/м3
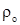 (СН4) = 16/22,4 = 0,714 кг/м3
(СН4) = 16/22,4 = 0,714 кг/м3
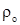 (С2Н6) = 30/22,4 = 1,339 кг/м3
(С2Н6) = 30/22,4 = 1,339 кг/м3
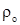 (С3Н6) = 42/22,4 = 1,875 кг/м3
(С3Н6) = 42/22,4 = 1,875 кг/м3
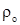 (С2Н2) = 26/22,4 = 1,161 кг/м3
(С2Н2) = 26/22,4 = 1,161 кг/м3
Объем при нормальных условиях [5]
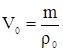
где 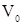 – объем, занимаемый газом при н.у., м3
– объем, занимаемый газом при н.у., м3
m–масса газа, кг
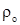 - плотность газа при н.у., кг/м3
- плотность газа при н.у., кг/м3
Объемный расход чистого 100%-ого этилена для получения дихлорэтана.
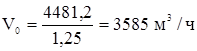
Общий объемный расход этиленовой фракции составит:
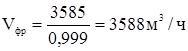
Расход остальных газов:
Пропилен 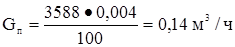 или
или 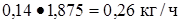
Метан 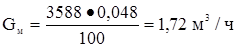 или
или 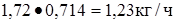
Этан 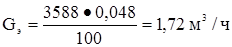 или
или 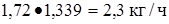
Общий массовый расход технического этилена составит:

Состав этилена в массовых процентах 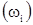 :
:
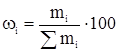 [5]
[5]
Этилен 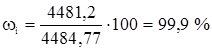
Пропилен 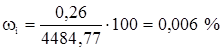
Метан 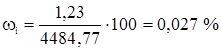
Этан 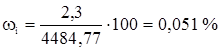
Общий расход хлора
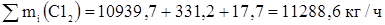
G = 11288,6 кг/ч – расход чистого 100%-ого хлора пошедшего на реакцию получения 1,2 – дихлорэтана и побочные реакции.
Определим состав технического хлора в массовых процентах.
Определим плотность газов, входящих в состав технического хлора.
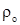 (Cl2) = 71/22,4 = 3,17 кг/м3
(Cl2) = 71/22,4 = 3,17 кг/м3
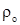 (Н2O) = 18/22,4 = 0,8 кг/м3
(Н2O) = 18/22,4 = 0,8 кг/м3
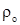 (O2) = 32/22,4 = 1,43 кг/м3
(O2) = 32/22,4 = 1,43 кг/м3
Объемный расход чистого 100%-ого хлора составит:
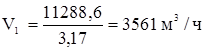
Объемный расход технического хлора:
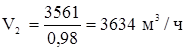
Остальные компоненты:
Вода 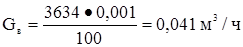 или
или 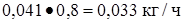
Кислород  или
или 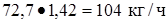
Массовый расход технического хлора.
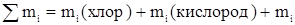 (вода)
(вода)
где 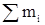 – массовый расход технического хлора
– массовый расход технического хлора
mi (хлор) – массовый расход 100%-ого (чистого) хлора
mi (кислород) – массовый расход 100%-ого (чистого) кислорода
mi (вода) – массовый расход 100%-ого (чистого) водяного пара
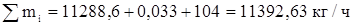
Определим состав технического хлора в массовых процентах.
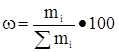 [5]
[5]
хлор 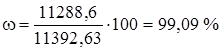
вода 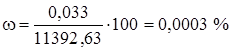
кислород 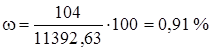
Таблица 5.1. Материальный баланс стадии прямого хлорирование этилена
| Приход | Расход | ||||||
| Компоненты | 
| 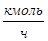
| % | Компоненты | 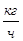
| 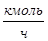
| % |
| Технический этилен в том числе: Этилен Пропилен Метан Этан Технический хлор, в том числе: Хлор Вода кислород | 4484,77 4481,2 0,3 1,23 2,3 11392,6 11288,6 0,033 104 | 160,17 160,04 0,007 0,07 0,07 160,46 159 0,002 3,25 | 27,88 72,12 | ДХЭ-товарный Побочные, в том числе: ТХЭ ВХ ХЭ Отходящие газы, в том числе: Хлористый водород Пропилен Метан Этан Вода Кислород Потери ДХЭ | 14943 342,4 311,3 15,56 15,56 193,3 85,4 0,2 1,23 2,3 0,033 104 395 | 151 2,85 3,17 0,24 0,24 5,85 1,2 0,007 0,07 0,07 0,002 3,25 4 | 94,73 1,98 1,17 2,2 |
| ИТОГО: | 15873,7 | 100 | ИТОГО: | 15873,7 | 100 | ||
Таблица 5.2. Материальный баланс реактора прямого хлорирование этилена
| Приход | Расход | ||||||
| Компоненты | 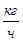
| 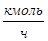
| % | Компоненты | 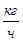
| 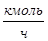
| % |
| Технический этилен, в том числе: Этилен Пропилен Метан Этан Технический хлор, в том числе Хлор Вода Кислород | 4484,77 4481,2 0,3 1,23 2,3 11392,6 11288,6 0,033 104 | 160,17 160,04 0,007 0,07 0,07 160,46 159 0,002 3,25 | 27,88 72,12 | ДХЭ-сырец, в том числе: ДХЭ ТХЭ ВХ ХЭ Остальные, в том числе: Хлористый водород Пропилен Метан Этан Вода Кислород | 15565 15254 311,3 15,56 15,56 193,3 85,4 0,3 1,23 2,3 0,033 104 | 157,2 154,1 3,2 0,24 0,24 5,85 1,2 0,007 0,07 0,07 0,002 3,25 | 94,73 1,17 |
| ИТОГО: | 15873,7 | 100 | ИТОГО: | 15873,7 | 100 | ||
Тепловой баланс
Уравнение теплового баланса в общем виде:
Q 1 + Q 2 + Q 3 + Q 4 + Q 5 + Q 6 + Q пот., [6]
где Q1, Q2, Q3, Q4 – тепловые потоки технического этилена, технического хлора азота и продуктов реакции соответственно, кВт;
Q5 – теплота экзотермических реакций;
Q6 – теплота, отводимая кипящим конденсатом, кВт;
Q пот. – теплопотери в окружающую среду, кВт
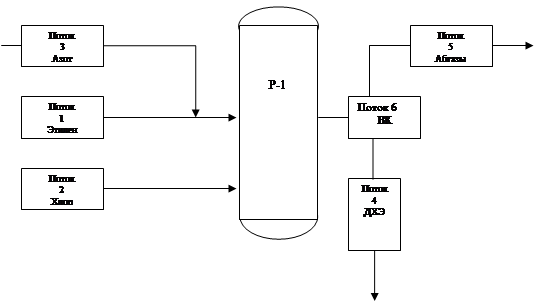
Исходные данные:
Материальные потоки (из таблицы материального баланса реактора)
Технический этилен: 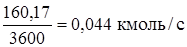
Технический хлор: 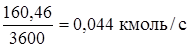
Продукты реакции (ДХЭ – сырец): 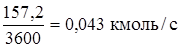
Остальные: 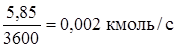
Для расчета тепловых расчетов технического хлора, технического этилена, продуктов реакции рассчитаем средние молярные теплоемкости:
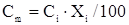 [6]
[6]
технического хлора при температуре:
Т1=25+273=298К
технического этилена при температуре:
Т2=25+273=298К
продуктов реакции при температуре:
Т3=55+273=328К
остальных при температуре:
Т4=55+273=328К
Средние молярные теплоемкости
| Наименование | 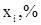
| 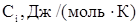
| 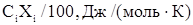
|
| Технический этилен: Этилен Пропилен Метан Этан Итого: Технический хлор: Хлор Вода Кислород Итого: Остальные газы + продукты реакции: ДХЭ ТХЭ ВХ ХЭ Хлористый водород Пропилен Метан Этан Вода Кислород | 99,9 0,006 0,027 0,05 100 99,1 0,0003 0,9 100 97,3 1,28 0,004 0,004 1,34 0,001 0,01 0,038 0,0012 0,009 | 43,56 63,89 35,71 52,64 33,93 75,42 29,37 79,63 148,50 53,68 12,76 29,0 76,08 39,74 63,02 34,23 30,02 | 43,52 0,004 0,009 0,026 43,56 33,62 0,00023 0,264 33,88 77,48 1,90 0,002 0,004 0,39 0,0001 0,0004 0,024 0,0004 0,0027 |
| ИТОГО: | 100 | 79,8 |
Тепловые потоки:
Технического этилена
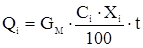 [6]
[6]
где GM – материальный поток, кмоль/с
t – температура, 0С
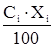 – средняя молярная теплоемкость, Дж/(моль·К)
– средняя молярная теплоемкость, Дж/(моль·К)
Технического этилена:
Q1=0,04·43,56·25 = 43,56 кВт
Технического хлора:
Q2=0,04·33,88·25 = 33,88 кВт
Продукты реакции +остальные:
Q3=(0,043+0,002)·79,8·55 = 197,5 кВт
Рассчитаем теплоты реакции.
Теплоты образования веществ (кДж/моль)
С2Н4 52,28 [5]
Cl2 0
HCl -92,31
C2H4Cl2 -130,02
C2H3Cl3 -138,49
C2H3Cl 31,37
C2H5Cl -105,0
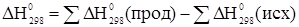 [5]
[5]
где 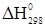 - теплота химической реакции
- теплота химической реакции
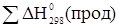 - теплота продуктов реакции
- теплота продуктов реакции
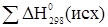 - теплота исходных веществ
- теплота исходных веществ
1. С2Н4+Сl2→C2H4Cl2
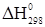 = -130,02 – (0+52,28) = -182,3 кДж/моль
= -130,02 – (0+52,28) = -182,3 кДж/моль
2. С2Н4+2Сl2→C2H3Cl3+НCl
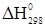 = -138,49+(-92,31) – 52,28 = -283,08 кДж/моль
= -138,49+(-92,31) – 52,28 = -283,08 кДж/моль
3. С2Н4+Сl2→C2H3Cl+НCl
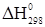 = 31,37+(-92,31) – 52,28= -113,22 кДж/моль
= 31,37+(-92,31) – 52,28= -113,22 кДж/моль
4. С2Н4+НСl→C2H5Cl
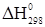 = -105,0 – (-92,31+52,28) = -64,97 кДж/моль
= -105,0 – (-92,31+52,28) = -64,97 кДж/моль
Теплота экзотермических реакций.
Qреак=[1000/3600] (17,89·182,3+2,4·283,08+0,28·113,22·0,27·64,97) = 9109,27 кВт
Общий приход тепла.
Qприх=Qреак+Q1+Q2 [6]
где Qприх – общий приход тепла
Q1 – тепловой поток технического этилена
Q2 – тепловой поток технического хлора
Qприх = 9109,27+43,56+33,88 = 9186,44 кВт
Потери тепла в окружающую среду принимаем равными – 5% от общего прихода тепла.
Qпотерь= 9186,44·0,05=459,32 кВт
Определим количество тепла, отводимое из реактора дихлорэтаном.
Qсжим = Qприх – Qпотерь - Qпрод.реак
Qсжим = 9186,44 – 459,32 – 197,5 = 8529,62 кВт
Данные расчета теплового баланса заносим в таблицу.
Таблица 6.2. Тепловой баланс реактора прямого хлорирования этилена
| Приход | Расход | ||||
| кВт | % | кВт | % | ||
| 1. Тепловой поток технического этилена. 2. Тепловой поток технического хлора. 3. Тепловой поток экзотермических реакций. | 43,56 33,88 9109,27 | 0,59 0,47 98,94 | 1. Тепловой поток: продукты реакции + остальные 2. Потери в окружающую среду. 3. Тепло, снимаемое в холодильнике | 197,5 459,32 8529,62 | 2,48 5,0 92,55 |
| ИТОГО: | 9286,44 | 100 | ИТОГО: | 9286,44 | 100 |
На основании теплового расчета определяем количество дихлорэтана, циркулирующее в холодильнике.
Формула: 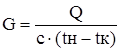 [6]
[6]
где G – количество дихлорэтана – сырца, кг/ч
Q – тепло, снимаемое в выносном холодильнике, кВт
С– теплоемкость ДХЭ – сырца, кДж/кг∙К
tн, tк – начальная и конечная температура ДХЭ – сырца.
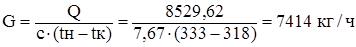
|
из
5.00
|
Обсуждение в статье: Расчет материального баланса установки |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

