 |
Главная |
Реактивы и оборудование
|
из
5.00
|
Штатив с зажимами, термометр до 200оС, спиртовка (электропечь), мешалка, пробирки различного диаметра, снабженные пробками с отверстиями под термометр, мешалка или меньшая пробирка.
Ход работы
3-5 г указанного в задании, полученном у преподавателя (таблица 1), чистого вещества или сплава заданного состава помещают в пробирку, снабженную термометром и мешалкой (ртутный шарик термометра должен быть погружен в вещество) и расплавляют над электрической плиткой или в пламени спиртовки. Пробирку с расплавом помещают в термостат - пробирку большего диаметра, снабженную пробкой с отверстием под пробирку с веществом, чтобы охлаждение было не слишком быстрым, и приступают к записи показаний термометра через каждые 15 секунд.
По окончании кристаллизации производят еще несколько отсчетов температуры, вновь расплавляют состав и удаляют термометр. Операцию повторяют для каждого чистого вещества и сплава указанного состава.
В случае бинарных сплавов, образующих эвтектику, сначала кристаллизуется один из компонентов, и кривая охлаждения должна иметь небольшой перегиб или остановку, отвечающие уменьшению скорости охлаждения, которые наблюдатель ошибочно может принять за эвтектическую точку. Поэтому опыта здесь прекращать не следует, а надо продолжать запись температуры вплоть до той остановки, которая соответствует истинной эвтектической температуре и должна быть общей для сплавов всех составов.
Обработка результатов
Данные показаний термометра вносят в таблицу 2. На основании этих данных строят кривые охлаждения для чистых веществ и ряда сплавов заданного состава в координатах: температура (Со) по оси ординат - время (секунда) по оси абсцисс. Температуры, соответствующие характерным точкам на кривых охлаждения, сводят в таблицу 3. На основании данных таблицы 3 строят диаграмму плавкости в координатах температура - состав (состав сплавов известен). По диаграмме плавкости определяют эвтектику данной системы.
Таблица 1
| № За- дания | Состав сплава (мас.% 1-го компонентов) | № За- да- ния | Состав сплава (мас.% 1-го компонентов) |
| 1 | NH4NO2, (NH4)2CO3 (0, 10, 30, 50, 70, 90, 100) | 6 | Ni(NO3)2·9H2O, Na2B4O7·10H2O (0, 10, 30, 50, 70, 90, 100) |
| 2 | Al(NO)3·9H2O, CoCl2·6H2O (0, 10, 30, 50, 70, 90, 100) | 7 | Al2(SO4)3·18H2O, Na2B4O7·10H2O (0, 10, 30, 50, 70, 90, 100) |
| 3 | Al2(SO4)3·18H2O, Co(NO3)2·6H2O (0, 10, 30, 50, 70, 90, 100) | 8 | Al(NO)3·9H2O, CoSO4·7H2O (0, 10, 30, 50, 70, 90, 100) |
| 4 | Mg(NO3)2·6H2O, CoSO4·7H2O (0, 10, 30, 50, 70, 90, 100) | 9 | Al2(SO4)3·18H2O, (NH4)2CO3 (0, 10, 30, 50, 70, 90, 100) |
| 5 | Na2B4O7·10H2O, Na3PO4·9H2O (0, 10, 30, 50, 70, 90, 100) | 10 | Na2B4O7·10H2O, (NH4)2CO3 (0, 10, 30, 50, 70, 90, 100) |
Таблица 2
| Номер и состав сплава | ||||
| 1 | 2 | 3 | 4 | 5 |
Таблица 3
| № Спла- ва | Состав сплава, мас. % | Ход кристаллизации | |
| Начало | Окончание | ||
| Показания термометра | Показания термометра | ||
Лабораторная работа №8
Коэффициент распределения
Настоящие методические указания составлены в соответствии со стандартом по физической химии для студентов технических высших учебных заведений по одному из разделов курса "Термодинамика", содержат краткое теоретическое введение и описание экспериментальной части работы
Цель работы: Исследование процесса экстрагирования, приобретение навыка экспериментального определения коэффициента распределения.
Распределение вещества между двумя ограниченно растворимыми жидкостями подчиняется закону распределения. Вещество, добавленное к системе, состоящей из двух нерастворимых жидкостей, распределяется между обеими фазами в определенном, постоянном при данной температуре отношении. Этот закон характеризует равновесное состояние системы и может быть выражен через коэффициент распределения как отношение молярных концентраций растворенного вещества в обеих фазах:
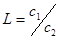
где c1, c2, - молярные концентрации растворенного вещества соответственно о верхней и нижней жидкой фазах; L - коэффициент распределения.
Насыщенный раствор малорастворимого вещества является разбавленным раствором и удовлетворительно подчиняется законам идеальных растворов. Указанное простейшее соотношение справедливо только тогда, когда растворяемое вещество в каждой из равновесных фаз находится в одинаковом молекулярном состоянии. Закон распределения не выполняется во всех случаях изменения состояния растворенных молекул хотя бы в одной из фаз системы. Такими изменениями могут быть диссоциация или ассоциация молекул растворенного вещества. В таком случае коэффициент распределения выражается уравнением:

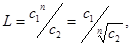
где n - средняя молекулярная масса растворенного вещества во втором и первом растворителях
Коэффициент распределении есть величина постоянная, не зависящая от количества растворенного вещества, определяется только природой растворителей, растворенного вещества и температурой. Зависимость коэффициента распределения от температуры определяется уравнением:
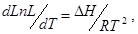
где Т - абсолютная температура;
R - универсальная газовая постоянная;
ΔH - изменение энтальпии при переходе вещества из одной фазы в другую.
Самый распространенный пример применения закона распределения – экстрагирование, т.е. извлечение вещества из раствора другим растворителем, который не смешивается с первым и растворяет извлекаемое вещество в большем количестве, чем первый. Следует учитывать, что экстракцию выгоднее вести последовательно несколькими порциями экстрагирующего вещества, чем однократно таким же количеством растворителя, но одной порцией.
Пример.
Пусть в первой фазе объемом V растворена масса m 0 вещества, подлежащего извлечению n порциями другого растворителя (экстрагента) объемом v каждая. Общий объем экстрагента V, (фаза 2). Коэффициент распределения равен L.
После первого экстрагирования в фазе 1 останется m 1 неизвлеченного вещества, а в экстракт перейдет (m 0 - m 1) растворенного вещества. Тогда
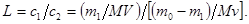
Следовательно, после первого экстрагирования в фазе 1 останется
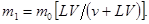
После второго экстрагирования в растворе останется m 2 неизвлеченного вещества, а в экстракт перейдет (m1-m2) вещества, т.е.
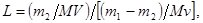
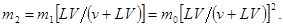
После n-ного экстрагирования в фазе 1 останется
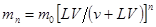 (1)
(1)
растворенного вещества, а всего будет извлечено
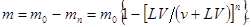
После однократного экстрагирования этого же вещества из данного раствора (фаза 1) вторым растворителем (фаза 2) общим объемом V 2 = nv останется неизвлеченным
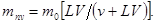 (2)
(2)
Из анализа (1) и (2) видно, что т nv > mn.
Реактивы и оборудование
Для определения коэффициента распределения необходимо иметь: технохимические весы с чувствительностью до 0,01 г, разновесы, три делительные воронки с притертой пробкой объемом 200 см3, три колбы с пробкой объемом 200 см3, стакан объемом 200 см3, цилиндры объемом 10 и 100 см3, бюретка, штативы с зажимами, толуол, дистиллированная вода, бензойная кислота, 0,1 н раствор Na2CO3, 1%-ный спиртовый раствор фенолфталеина.
Ход работы
В три делительные воронки напивают по 50 см3 дистиллированной воды. В каждую воронку добавляют соответственно 0,25, 0,50, 0,75 г бензойной кислоты и добавляют по 50 см3 толуола. Делительные воронки плотно закрывают притертыми пробками и интенсивно встряхивают в течение 25-30 минут. Затем закрепляют в штативе и дают отстояться в течение 30 минут. Затем водный слой из первой воронки отделяют, осторожно сливая нижнюю часть смеси в стакан. В коническую колбу приливают 10 см3 дистиллированной воды и добавляют 10 см3 толуольного раствора из делительной воронки и 3-4 капли раствора фенолфталеина. Добавление воды необходимо для улучшения результатов последующего титрования.
Приготовленный раствор титруют раствором Na2CO3 заданной концентрации. Титрование повторяют 2-3 раза. Расхождение между отдельными определениями не должно превышать 0,2 см3.
Аналогично проводят определение бензойной кислоты в водном (нижнем) слое.
Опыт выполняют для всех трех растворов.
Обработка результатов
Экспериментальные данные вносят в таблицу.
| Масса бензойной к-ты, г | Фаза органического растворителя | Водная фаза
| Коэффициент распределения | |||||||
| m, г | V,см3 Na2CO3 | c1 | V,см3 Na2CO3 | c1 | L | |||||
|
| 1. | 1. | 1. | 1. |
| |||||
| 0,25 | 2. | 2. | 2. | 2. |
| |||||
|
| 3. | 3. | 3. | 3. |
| |||||
|
| cр. | ср. | ср. | ср. |
| |||||
|
| 1. | 1. | 1. | 1. |
| |||||
| 0,50 | … | … | … | … |
| |||||
| 0,75 | … | … | … | … |
| |||||
Концентрацию бензойной кислоты определяют по уравнению-
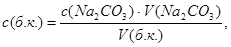
где c ( Na 2 CO 3 )- концентрация раствора карбоната натрия,
c (б.к.) – концентрация бензойной кислоты в исследуемой фазе,
V ( Na 2 CO 3 ) – объем раствора карбоната натрия, израсходованного на титрование, см3,
V (б.к.)- объем взятого для титрования раствора бензойной кислоты, см3.
При вычислении коэффициента распределения берут отношение концентрации бензойной кислоты в водном слое к корню квадратному из концентрации бензойной кислоты в органическом слое. 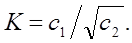
Лабораторная работа № 9
Определение энтальпии реакции нейтрализации
Настоящие методические указания составлены в соответствии со стандартом по физической химии для студентов технических высших учебных заведений по одному из разделов курса "Термодинамика"
Целью работы является усвоение важнейших понятий в термодинамике, экспериментальное определение энтальпии химической реакции.
При подготовке к лабораторной работе необходимо обратить внимание на основные положения теории электролитической диссоциации, согласно которой реакции в растворах электролитов протекают между ионами. Поэтому реакцию нейтрализации можно представить как взаимодействие ионов водорода с гидроксильными ионами с образованием слабо диссоциирующих молекул воды
H+ + OH- → H2O + ΔH
Следовательно, при нейтрализации любой сильной кислоты сильным основанием должен наблюдаться практически одинаковый тепловой эффект ΔН, который по мере разбавления растворов реагентов приближается к предельной величине, ровной -55,9 кДж/моль при 298°К (энтальпия нейтрализации).
Нейтрализации слабых кислот и оснований предшествует процесс диссоциации слабой кислоты (основания) на ионы, поэтому суммарная (интегральная) энтальпия нейтрализации в данном случае, как правило, меньше, чем 55,9 кДж/моль.
Реактивы и оборудование
Для определения теплоты нейтрализации используют калориметр, состоящий из реакционного сосуда емкостью 50 см3, который помещен в изотермическую оболочку. В пробке, закрывающей реакционный сосуд, имеются отверстия для мешалки и термометра. Растворы реагирующих веществ напивают через боковой отросток.
Для работы необходимы также мерные колбочки объемом 25 и 50 см3 или пипетки объемом 25 и 50 см3, весы с чувствительностью не менее 0,01 г, ступка с пестиком, секундомер, термометр с чувствительностью не менее 0,1°, калька, миллиметровая бумага.
В работе используют серии растворов НС1, Н2SО4, СН3СООН (НАс), NН4ОН, НNО3, КОН, NaOH различной концентрации (2н, 1н, 0,5н), а также сухуюсоль КNО3, предварительно высушенную при 110°С в течение 4 часов.
Ход работы.
|
из
5.00
|
Обсуждение в статье: Реактивы и оборудование |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

