 |
Главная |
числом электронов на внешнем энергетическом уровне, равным номеру группы.
|
из
5.00
|
Побочная подгруппа - это вертикальная последовательность d- и f-элементов, которые имеют
Одинаковое суммарное количество валентных электронов.
Следовательно, возможна третья формулировка Периодического закона, которая отражает
причину периодического изменения свойств.
Свойства химических элементов и образованных ими соединений находятся в периодической
Зависимости от строения внешних энергетических уровней атомов.
Изменение свойств элементов по диагонали
Под диагональной периодичностью понимают повторяемость сходства химических свойств простых
веществ и соединений элементов, расположенных по диагонали друг от друга. Диагональ из левого верхнего угла к нижнему правому объединяет отчасти сходные элементы. Это объясняется приблизительно одинаковым увеличением неметаллических свойств в периодах и металлических
свойств в группах.
| Группа Период | I | II | III | IV | V |
| 2 |  Li Li
|  Be Be
|  B B
|  C C
| N |
| 3 | Na | Mg | Al | Si | P |
Литий Li и его соединения больше похожи на магний Mg и его соединения. Бор B больше напоминает
кремний Si, чем алюминий Al.
Если провести диагональ от бериллия 4 Be до астата 85 At, то она условно разделит элементы на металлы и неметаллы. Вдоль этой диагонали будут расположены переходные элементы, соединения которых обладают амфотерными (двойственными) свойствами.
"Звездная периодичность" химических элементов
Под "звездной периодичностью" подразумевают изменение свойств элементов с учетом горизонтальной, вертикальной и диагональной периодичности.
"Звездная периодичность" наблюдается как у элементов главных, так и побочных подгрупп.
 Li Be B Cr Mn Fe
Li Be B Cr Mn Fe
 |  |



 Na Mg Al Mo Tc Ru
Na Mg Al Mo Tc Ru
 |  |  |  |  |  | ||||||
K Ca Sc W Re Os
рис. 2.
«Звездность» Периодической системы
Свойства центрального элемента являются средними из свойств элементов, окружающих его.
Обобщение всех видов периодичности изменений свойств элементов позволяет предсказывать и
открывать новые химические элементы.
Радиус атома по периоду уменьшается, а по группе возрастает.
 |




















































 Ra
Ra

 | |||
 | |||
Ассоциация: «Снежная баба, смотрящая вдаль»
Задания для самостоятельного решения


№1

№2

№3
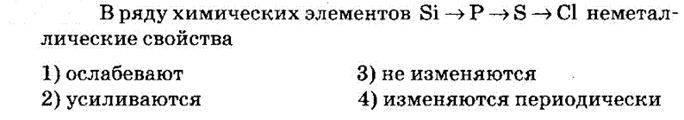
№4
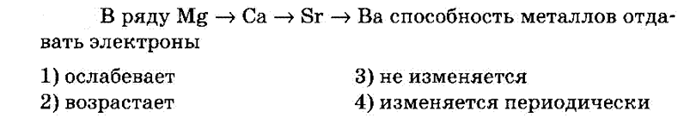
№5
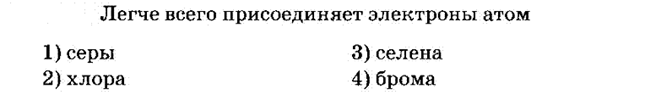
№6

№7

№8
№9 

№10

№11

№12

№13

№14

№15

№16

№17

№18

№19

№20

№21

№22

№23

№24
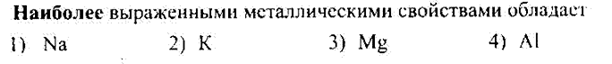
№25
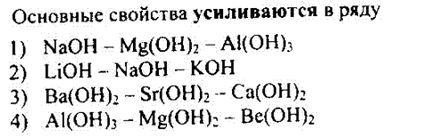
№26

№27

№28

№29

№30
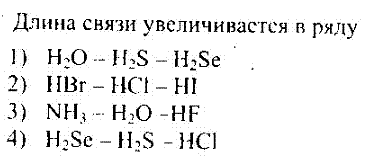
№31

№32

№33

№34

№35

№36
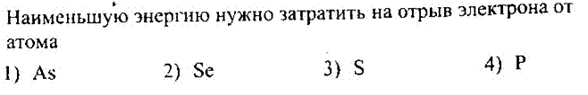
№37
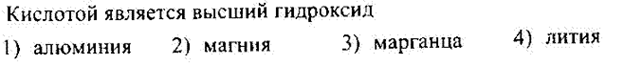
№38
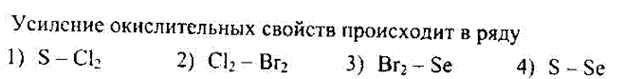
№39
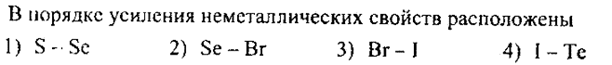
№40

№41
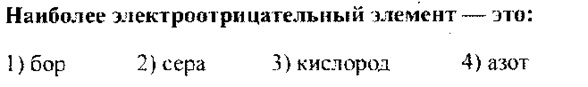
№42
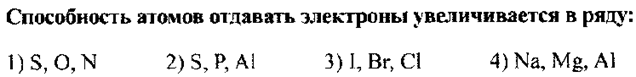
№43
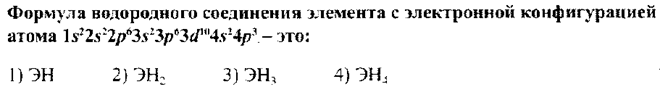
№44

№45

№46

№47

Ответы
| Номер вопроса | Ответ |
| 1 | 1 |
| 2 | 1 |
| 3 | 2 |
| 4 | 2 |
| 5 | 2 |
| 6 | 1 |
| 7 | 3 |
| 8 | 2 |
| 9 | 3 |
| 10 | 2 |
| 11 | 4 |
| 12 | 4 |
| 13 | 1 |
| 14 | 4 |
| 15 | 3 |
| 16 | 4 |
| 17 | 4 |
| 18 | 2 |
| 19 | 2 |
| 20 | 1 |
| 21 | 2 |
| 22 | 2 |
| 23 | 2 |
| 24 | 2 |
| 25 | 3 |
| 26 | 1 |
| 27 | 4 |
| 28 | 3 |
| 29 | 1 |
| 30 | 4 |
| 31 | 4 |
| 32 | 2 |
| 33 | 4 |
| 34 | 3 |
| 35 | 4 |
| 36 | 1 |
| 37 | 3 |
| 38 | 1 |
| 39 | 2 |
| 40 | 2 |
| 41 | 3 |
| 42 | 2 |
| 43 | 3 |
| 44 | 3 |
| 45 | 2 |
| 46 | 4 |
| 47 | 3 |
| 48 | 2 |
Литература
I. А.В. Гурова, О.Е. Рыбникова «Периодическая система химических элементов Д.И. Менделеева», М.: АСТ: Астрель, 2007.
II. А.А.Каверина, Ю.Н. Медведев, Д.Ю. Добротин «ЕГЭ 2009. Химия: Сборник экзаменационных заданий», М.: Эксмо, 2009.
III. Под редакцией А.А.Кавериной; Министерство образования и науки РФ, Федеральная служба по надзору в сфере образования и науки, Федеральный институт педагогических измерений «Единый государственный экзамен: контрольные измерительные материалы», М.: Просвещение, 2006.
IV. В.Ю. Мишина, Е.Н. Стрельникова «Единственные реальные варианты заданий для подготовки к единому государственному экзамену», М.: Федеральный центр тестирования, 2006.
V. ФИПИ «Единый государственный экзамен 2009. Химия. Универсальные материалы для подготовки учащихся», М.: Интеллект – Центр, 2009.
VI. Э.М. Левина «ЕГЭ. Химия: Типовые тестовые задания», СПб.: Тригон, 2008.
|
из
5.00
|
Обсуждение в статье: числом электронов на внешнем энергетическом уровне, равным номеру группы. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

