 |
Главная |
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов
|
из
5.00
|
Реферат
слушателя курса повышения квалификации группы Х-1
учителя химии МОУ СОШ №6 Ленинского района г. Ульяновска
Фёдоровой Ирины Владимировны
По теме: «Подготовка учащихся к ЕГЭ. По вопросу:
«Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
Радиусы атомов, их периодические изменения в системе химических элементов.
Закономерности изменения химических элементов и их соединений по периодам и группам.
(вопросы А-2, А-7)»»
Научный руководитель:
Заведующий кафедрой естествознания
Кандидат химических наук,
доцент Ахметов М.А.
Ульяновск, 2009 г.
Введение
Анализ результатов ЕГЭ 2008 года показал положительное усвоение на базовом уровне школьного курса по вопросу: Периодический закон и Периодическая система химическая система Д.И. Менделеева; современное представление о строении атома; электроотрицательность; закономерность изменения радиусов атомов в системе химических элементов по периодам и группам, а также изменение химических свойств элементов и их соединений.
Основы данного материала закладываются уже в 8 классе. Для этого важно, чтобы учащиеся овладели необходимыми опорными знаниями по данным вопросам. Для лучшего восприятия изучаемого материала я использую различные наглядные таблицы и схемы, которые будут освещены в теоретической части. Практически учащиеся изготавливают карточки 20 – 40 химических знаков и постепенно по мере изучения материала заполняют характеристику каждого химического элемента по плану:
I. Nп/п , N периода, N группы, подгруппа (А,Б)
II. Состав ядра (сумма протонов, нейтронов)
III. Электронное строение
IV. Ме, неМе, инертный газ
V. Степень окисления
VI. Высший оксид –> гидроксид
VII. Водородное соединение
VIII. Сравнение химического элемента с рядом стоящими элементами по периоду и группе
Такой подход вызывает непроизвольный интерес учащихся, улучшает запоминание информации и практическое применение знаний. На разных этапах изучения учащиеся 11 классов помогают в проверке деятельности учащихся 8 классов. В 9 классе эти же карточки используются при изучении отдельных химических элементов и групп химических элементов. Данная методика изучения позволяет закреплять опорные знания по теме.
Теоретическая часть
Периодический закон.
Периодическая система химических элементов
Д.И. Менделеева в свете строения атома.
1 марта 1869 года русский ученый Д.И. Менделеев открыл Периодический закон – первую естественную классификацию химических элементов. Это был итог исследованию самого ученого и обобщение опыта других исследователей. Ни одна классификация химических элементов до Менделеева не была полной. Он был убежден в том, что между всеми химическими элементами имеется закономерная связь. В основу классификации он положил атомную массу.
Формулировка Периодического закона, данная Д.И. Менделеевым:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов
После открытия строения атома стало возможным дать более точную современную формулировку Периодического закона:
Свойства химических элементов и образованных ими соединений находятся в периодической зависимости от заряда ядра их атомов.
В Периодической системе химических элементов Д.И. Менделеева, графическом изображении Периодического закона, каждое обозначение: порядковый (атомный) номер элемента, номер периода номер группы связано со строением атома.
| Порядковый номер элемента | Номер периода | Номер группы (для элементов главных групп) |

| 
| 
|
| = заряду ядра атома | = количеству энергетических уровней в атоме | = количеству электронов e- на внешнем энергетическом уровне |
| = количеству протонов р+ в ядре | = высшей положительной степени окисления | |
| = количеству электронов е- в атоме | = высшей валентности элемента по кислороду |
Для элементов неметаллов по номеру группы можно определить низшую степень окисления и количество непарных электронов на внешнем энергетическом уровне атома. Для этого из номера группы, в которой находится элемент, надо вычесть максимальный номер группы 8.
Например:
| Химический элемент | Порядковый номер элемента №15 | Номер периода 3 | Номер группы для элементов главных подгрупп VA |

| 
| 
| |
| Фосфор P | Z = +15 заряд ядра атома р+ = 15 количество протонов в ядре е- = 15 количество электронов в атоме | 3 энергетических уровня в атоме | 5е- электронов на внешнем энергетическом уровне +5 высшая положительная степень окисления V высшая валентность по кислороду -3 низшая степень окисления (5 – 8 = 3) 3е- непарных электрона в атоме фосфора |
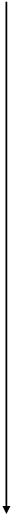

 Периоды Za
Периоды Za

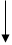 Группы Ra
Группы Ra
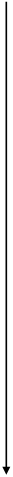

 ne- на внешнем уровне
ne- на внешнем уровне
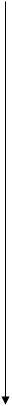
 Э.О.
Э.О.

 Восстановительные свойства (- e-)
Восстановительные свойства (- e-)

 Окислительные свойства (+ e-)
Окислительные свойства (+ e-)

 Металлические свойства
Металлические свойства

 Неметаллические свойства
Неметаллические свойства
п
о
с
т
о
я
н
н
о
- увеличение
| Za – заряд ядра атома Ra – радиус атома ne- – количество электронов на внешнем уровне Э.О. – электроотрицательность (- e-) – отдача электронов (+ e-) – прием электронов |
рис. 1.
Изменение свойств элементов по
горизонтали (по периодам) и вертикали (по группам)
Причина изменения свойств также объясняется строением атомов химических элементов.
Каждый период начинается элементом щелочным металлом (исключение – первый период), в атомах которых на внешнем энергетическом уровне имеются один s – электрон. Общая электронная формула строения внешнего энергетического уровня щелочных металлов ns1 , где n – номер периода.
Каждый период заканчивается элементом благородным газом. В атомах элементов благородных
газов на внешнем энергетическом уровне имеются два s- и шесть p-электронов. Общая электронная формула строения внешнего энергетического уровня благородных газов ns2 np6 , где n - номер периода
(исключение: гелий He - ns2).
Период - это горизонтальная последовательность элементов по возрастанию порядкового
(атомного) номера элемента, атомы которых имеют одинаковое число энергетических уровней,
численно равное номеру периода.
В периодах металлические свойства уменьшаются, а неметаллические свойства увеличиваются.
В больших периодах изменения свойств происходят медленнее, что объясняется появлением десяти
d-элементов (4-й, 5-й периоды) и четырнадцати f-элементов (6-й, 7-й периоды).
По группам (в главных подгруппах) металлические свойства увеличиваются, а неметаллические
уменьшаются.
Группа - это вертикальная последовательность элементов по возрастанию порядкового (атомного) номера, обладающая схожими свойствами.
Главная подгруппа - это вертикальная последовательность s- и p-элементов с одинаковым
|
из
5.00
|
Обсуждение в статье: Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы



 - уменьшение
- уменьшение - остается постоянным
- остается постоянным