 |
Главная |
Ингибиторная активность флавоноидов
|
из
5.00
|
Флавоноиды ингибируют процессы ПОЛ как на стадии инициации, взаимодействуя с радикалами О- и ОН*, так и на стадии продолжения цепи, выступая донорами атомов водорода для перекисных радикалов. Образующиеся при этом радикалы флавоноидов активно вступают в реакции диспропорционирования с другими радикалами (таблица 2). Флавоноиды (за исключением флавонов и флаванонов) эффективно ингибировали супероксидные анион-радикалы, возникающие при взаимодействии Н202 с ацетоном в щелочной среде, для антирадикальной активности важным было присутствие гидроксильных групп в В-кольце и положении СЗ, при этом агликоны были более эффективны, чем гликозилированные формы [69].
Структурный анализ и экспериментальные данные свидетельствуют о прямой взаимосвязи между антиоксидантной эффективностью флавоноидов и количеством фенольных ОН-групп в их молекулах [5, 43, 50]. Исследование разных по структуре флавоноидов показало, что соединения без ОН-заместителей или с одной гидроксилыгой группой в положении С5 флавонового ядра не проявляют сколько-нибудь значимой активности в отношении перекисных радикалов, возникающих при разложении 2,2'-азобис(2-амидинопропан)дигидрохлорида; эффективность флавонов с одним ОН-заместителем в положениях СЗ, С6, С2', СЗ' или С4' составляла меньше 60 % эффективности тролокса [13].
Таблица 2. Константы ингибирования радикалов флавоноидами и эфирами галловой кислоты [11].
|
| Число реакционно-способных ОН-групп | Константы скорости ингибирования | ||
| .ОН (х 109 М-1с-1) | .N3 (х 109 М-1 с-1) | .O 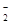 (х 104 М-1 с-1) (х 104 М-1 с-1)
| ||
| (-)Эпикатехин | 2 | 1,0 | 4,0 | 6,8 |
| (+)Катехин | 2 | 2,2 | 5,0 | 6,4 |
| Пикногенол | 2 | 1,8 | 1,75 | 43 |
| (-)Эпигаллокатехин | 3 | 4,7 | 4,7 | 41 |
| (-)Эпикатехина галлат | 5 | 5,8 | 4,7 | 43 |
| (-)Эпигаллокатехина галлат | 6 | 7,1 | 4,8 | 65 |
| Пропилгаллат | 3 | 3,1 | 4,2 | 26 |
| Р-Глюкогаллин | 3 | 4,4 | 6,3 | 65 |
| Пентагаллоил-глюкоза | 15 | 71 | 20 | 103 |
| Галлодубильная кислота (танин) | 25 | 31 | 22 | - |
Таблица 3. Ингибирование основными флавонами и катехинами чая продукции О2- ксантиноксидазой [6].
| Катехин, флавон | Тип ингибирования | IС50 (мкМ) |
| Катехин | неконкурентное | 303,95 |
| Эпикатехин | смешанное | 20,48 |
| Эпигаллокатехин | смешанное | 10,66 |
| Эпикатехина галлат | смешанное | 2,86 |
| Эпигаллокатехина галлат | конкурентное | 0,76 |
Многие флавоноиды, такие как кверцетин, мирицетин, лютеолин, рамнетин, силибинин, не только обладают антиоксидантной активностью, но и способны ингибировать циклооксигеназы 1 и 2 типа, липоксигеназы и тем самым снижать продукцию провоспалительных медиаторов: лейкотриенов, простагландинов и активных форм кислорода [55, 61, 62]. Супрессивная эффективность флавоноидов в отношении 5-липоксигеназы и циклооксигеназы перитонеальных лейкоцитов крыс коррелировала с их способностью связывать и восстанавливать ионы железа [49].
В сложных системах, таких как индуцированное ионами металлов переменной валентности окисление линоленовой кислоты в гепатоцитах [73], прямой взаимосвязи антиоксидантного действия флавоноидов с определёнными структурными элементами их молекул выявить не удаётся, что объясняется исследователями наличием в молекулах флавоноидов нескольких центров связывания ионов металлов. Исследование на культурах клеток сетчатки эмбрионов цыплят показало, что в отношении Fe2+-индуцированного окисления в присутствии аскорбата, восстанавливающего ионы железа (III), защитная роль флавоноидов (кверцетин, лютеолин, таксифолин, эриодиктиол) не зависела от наличия двойной связи С2-СЗ (эриодиктиол и таксифолин с насыщенной связью С2-СЗ были более активны, чем кверцетин и лютеолин), также не выявлялось зависимости от наличия гидроксильной группы в СЗ-положении; в наибольшей степени эффективность флавоноидов в данной экспериментальной системе определялась способностью молекул проникать в липидный слой мембран и образовывать водородные связи [3]. Катехин (таблица 3) существенно снижал индуцированную гидроперекисью линолевой кислоты гибель эндотелиальных клеток человека в культуре, в то же время (-) эпикатехин и (-)эпигаллокатехин были малоэффективны [42]. Морин, имеющий ОН-заместители в положениях С2' и С4', в меньших по сравнению с кверцетином и катехи-ном концентрациях подавлял некроз эндотелиальных клеток свиньи, возникающий поддействием ксантин-ксантиноксидазной системы, что, по-видимому, связано с ингибированием им ксантиноксидазы [79]. Байкалеин и байкалин предотвращали гибель клеток нейробластомы человека и снижали образование малонового диальдегида под действием Н202; не содержащие С6-гидроксильной группы флавоны (вогонин и вогонозид) в данной системе не проявляли защитного эффекта [27].
В гетерофазных системах, таких как клетки или липопротеины, антиоксидантная эффективность флавоноидов во многом определяется их липофильностью и гидрофильностью [3, 15]. В экспериментальной системе окисления рапсового масла при 105 °С мирицетин проявлял значительно более выраженную ингибирующую активность, чем кверцетин, однако в другой модельной системе (окисление липидов мембран эритроцитов) эффективнее был кверцетин, что связывается с его большей липофильностью [15]. Анализ действия разных по структуре флавоноидов на индуцированные ионами железа процессы ПОЛ в выделенных митохондриях также показал, что их активность главным образом зависит от хелаторных и липофильных свойств молекул, при этом метилирование всех ОН-групп в молекуле кверцетина не снижало антиокислительной активности [67]. На модели ишемии/реперфузии изолированного сердца крысы катехин, введённый в перфузат, предотвращал высвобождение ионов железа и снижал повреждение митохондрий [77].
Помимо того, что флавоноиды обладают антирадикалыюй активностью и могут связывать ионы металлов переменной валентности, они аналогично токоферолу и холестерину стабилизируют мембраны и выступают в качестве структурных антиоксидантов. Проникая в гидрофобную область мембран, молекулы флавоноидов значительно снижают подвижность липидов, что в свою очередь, снижает эффективность взаимодействия пероксильных радикалов с новыми липидными молекулами (RО2* + RH —> ROOH + R*); так как в большинстве биологических мембран данная стадия цепных процессов ПОЛ является лимитирующей, то, соответственно, снижается скорость всего процесса окисления [4].
Показано ингибирование флавоноидами активности самых разных ферментов, таких как липоксигеназа, циклооксигеназа, монооксигеназы, ксантиноксидаза, митохондриальные сукцинатдегидрогеназа и НАДН-оксидаза, фосфолипаза А2 [13, 31], топоизомеразы и всевозможные протеинкиназы: протеинкиназа С, протеин-киназа В (Akt), мембранная и цитозольная тирозинкиназы, фосфатидилинозитол-3-киназа (PI3K), внеклеточнорегулируемая киназа (ERK), казеинкиназа 2 (СК2), АМФ-активируемая протеинкиназа (АМРК), и многие другие [20, 54, 56], при этом подавление активности киназ осуществляется преимущественно по одному общему механизму, путём конкуренции с АТФ за соответствующий участок связывания на ферменте [54].
|
из
5.00
|
Обсуждение в статье: Ингибиторная активность флавоноидов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

