 |
Главная |
Ксенокомпоненты атмосферы, включая антропогенные загрязнители.
|
из
5.00
|
Метан и другие газообразные углероды
Незначительное количество метана  постоянно отмечается в земной атмосфере. Он образуется в процессе разложения органического вещества при условии недостатка кислорода почвах, особенно в болотах ( болотный газ ) и захороненных осадках. Процесс преобразования захороненного органического вещества в каменные угли и жидкие углеводороды сопровождается отделением значительного количества метана. Так, метан составляет около 90% массы газа в его месторождениях. Поступление метана из осадочных толщ, газовых, нефтяных и угольных месторождений, а также из разлагающихся в восстановительных условиях органических остатков является естественным источником этого наиболее простого углеводорода в атмосфере. Некоторая часть метана в биосфере окисляется особыми видами бактерий до углекислого газа и воды по схеме:
постоянно отмечается в земной атмосфере. Он образуется в процессе разложения органического вещества при условии недостатка кислорода почвах, особенно в болотах ( болотный газ ) и захороненных осадках. Процесс преобразования захороненного органического вещества в каменные угли и жидкие углеводороды сопровождается отделением значительного количества метана. Так, метан составляет около 90% массы газа в его месторождениях. Поступление метана из осадочных толщ, газовых, нефтяных и угольных месторождений, а также из разлагающихся в восстановительных условиях органических остатков является естественным источником этого наиболее простого углеводорода в атмосфере. Некоторая часть метана в биосфере окисляется особыми видами бактерий до углекислого газа и воды по схеме:
 + 2
+ 2  →
→  + 2
+ 2 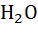 .
.
Содержание более тяжелых, чем метан углеводородов в тропосфере ничтожно и практически не поддается определению. Тяжелыми углеводородами обогащены газы нефтяных месторождений ( 17% ), в то время как в месторождениях газа среднее содержание тяжелых углеводородов в среднем составляет около 3%[6].
Окись углерода
В отличие от углекислого газа, являющегося вместе с кислородом основой жизни на Земле. Окись углерода СО не характерна для природных процессов в окружающей среде. Обладая токсическими свойствами, окись углерода отрицательно действует на живые организмы. Концентрации СО, превышающие 10 мг на 1 м³ воздуха, опасны для здоровья человека[2].
Появление окиси углерода в тропосфере является полностью следствием деятельности человека, если исключить образование некоторого количества ее во время лесных пожаров. В этой связи содержание окиси углерода в воздухе может служить объективным показателем степени его загрязненности[2].
Исходя из годового потребления жидкого топлива различными странами, поступление техногенной окиси углерода в тропосферу может быть оценено в 230 млн. т/год[2].
Содержание окиси углерода в воздухе уже в настоящее время в ряде крупных городов (Нью-Йорк, Лос-Анджелес, Токио и др.) представляет угрозу для здоровья людей, особенно в жаркие и безветренные периоды года[2].
Сероводород
Поступление незначительных количеств природного сероводорода 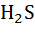 в атмосферу в основном обусловлено процессами бактериального разложения органического вещества в условиях резкого недостатка кислорода. Некоторое количество
в атмосферу в основном обусловлено процессами бактериального разложения органического вещества в условиях резкого недостатка кислорода. Некоторое количество 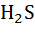 выбрасывается в атмосферу вместе с другими газами в результате вулканических процессов, а также поступает на поверхность с термальными источниками[1].
выбрасывается в атмосферу вместе с другими газами в результате вулканических процессов, а также поступает на поверхность с термальными источниками[1].
Бактерии-десульфузаторы, участвующие в процессах разложения органического вещества, проходящих без доступа воздуха, восстанавливают присутствующий в органических остатках сульфат-ион  . При этом отработанный у сульфат-иона кислород используется для дальнейшего окисления органического вещества. Бактерии этой группы могут использовать в пищу не только разлагающиеся остатки растений и животных, но также и ископаемые углеводороды – различные битумы, нефть и т. д. По подсчетам, количество сероводорода, ежегодно выделяемого в результате деятельности бактерий-десульфуризаторов, измеряется ( в расчете на серу ) в 4,2*
. При этом отработанный у сульфат-иона кислород используется для дальнейшего окисления органического вещества. Бактерии этой группы могут использовать в пищу не только разлагающиеся остатки растений и животных, но также и ископаемые углеводороды – различные битумы, нефть и т. д. По подсчетам, количество сероводорода, ежегодно выделяемого в результате деятельности бактерий-десульфуризаторов, измеряется ( в расчете на серу ) в 4,2*  моль. Из них лишь 1,0*
моль. Из них лишь 1,0*  моль поступает с континентов, а остальная часть ( 3,2*
моль поступает с континентов, а остальная часть ( 3,2*  моль) поставляется океанами[1].
моль) поставляется океанами[1].
В тропосфере сероводород неустойчив и в результате реакции с кислородом воздуха преобразуется в S  . Хотя эта реакция в изолированных условиях протекает достаточно медленно, однако присутствие в тропосфере аэрозолей и мельчайших капелек воды резко ускоряет ее прохождение[1].
. Хотя эта реакция в изолированных условиях протекает достаточно медленно, однако присутствие в тропосфере аэрозолей и мельчайших капелек воды резко ускоряет ее прохождение[1].
Повышение концентрации 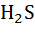 в воздухе представляет опасность для здоровья и даже жизни живых существ, в том числе и человека. В этой связи промышленные источники, выделяющие в составе отходов
в воздухе представляет опасность для здоровья и даже жизни живых существ, в том числе и человека. В этой связи промышленные источники, выделяющие в составе отходов 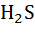 , должны строго контролироваться. К их числу относится ряд химических производств, в том числе процессы переработки каменных углей, осуществляемые без доступ воздуха, и т. д[1].
, должны строго контролироваться. К их числу относится ряд химических производств, в том числе процессы переработки каменных углей, осуществляемые без доступ воздуха, и т. д[1].
Сернистый газ
Содержание природного  в атмосфере ничтожно, его источниками являются вулканические процессы и окисление в воздухе сероводорода, поступающего в результате жизнедеятельности бактерий-десульфузаторов. Незначительные количества
в атмосфере ничтожно, его источниками являются вулканические процессы и окисление в воздухе сероводорода, поступающего в результате жизнедеятельности бактерий-десульфузаторов. Незначительные количества  выделяются в воздух также в результате окисления с поверхности рудных месторождений, содержащих сульфиды. В почвенном воздухе над месторождениями сульфидных руд содержание сернистого газа составляет 25-50 частей на миллиард при фоновой концентрации от -15 до 10 частей на миллиард. Таким образом, источники природного
выделяются в воздух также в результате окисления с поверхности рудных месторождений, содержащих сульфиды. В почвенном воздухе над месторождениями сульфидных руд содержание сернистого газа составляет 25-50 частей на миллиард при фоновой концентрации от -15 до 10 частей на миллиард. Таким образом, источники природного  ограничены в масштабах. Однако поступление в тропосферу значительных количеств техногенного сернистого газа уже в настоящее время представляет одну из наиболее серьезных проблем загрязнения окружающей среды[2].
ограничены в масштабах. Однако поступление в тропосферу значительных количеств техногенного сернистого газа уже в настоящее время представляет одну из наиболее серьезных проблем загрязнения окружающей среды[2].
Присутствие  в атмосфере оказывает не только прямое отрицательное воздействие на жизнедеятельность животных и растений. Взаимодействуя с кислородом воздуха,
в атмосфере оказывает не только прямое отрицательное воздействие на жизнедеятельность животных и растений. Взаимодействуя с кислородом воздуха,  преобразуется в крайне реакционноспособный
преобразуется в крайне реакционноспособный  , который с водой атмосферы дает серную кислоту. Разрушительные свойства последней общеизвестны. Реакция окисления сернистого газа до
, который с водой атмосферы дает серную кислоту. Разрушительные свойства последней общеизвестны. Реакция окисления сернистого газа до 
 О +М →
О +М →  +
+  ;
;
2  +
+  + окислители →
+ окислители →  ;
;
 +
+ 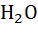 →
→  .
.
Где М – любая молекула газа. Первая реакция требует одновременно столкновения молекулы  , атомарного газа и любой другой газообразной молекулы, которая служит для отвода образуемой в процессе столкновения и реакции энергии. Иначе этот процесс же пойдет в обратном направлении и
, атомарного газа и любой другой газообразной молекулы, которая служит для отвода образуемой в процессе столкновения и реакции энергии. Иначе этот процесс же пойдет в обратном направлении и  вновь будет преобразован в
вновь будет преобразован в  с отщеплением атома кислорода. Особенно благоприятные условия для прохождения этой реакции существуют в пределах озонового слоя атмосферы, где атомарный кислород непрерывно генерируется в процессе распада молекул на О и
с отщеплением атома кислорода. Особенно благоприятные условия для прохождения этой реакции существуют в пределах озонового слоя атмосферы, где атомарный кислород непрерывно генерируется в процессе распада молекул на О и  . В результате в стратосфере на высоте порядка 18 км существует слой с повышенной концентрацией
. В результате в стратосфере на высоте порядка 18 км существует слой с повышенной концентрацией  , поскольку
, поскольку  легко соединяется с присутствующей в атмосфере водой. Вторая реакция для быстрого осуществления требует присутствия окислителей. Последние всегда накапливаются в воздухе, загрязненном в результате производственной деятельности человека. Таким образом, окисление
легко соединяется с присутствующей в атмосфере водой. Вторая реакция для быстрого осуществления требует присутствия окислителей. Последние всегда накапливаются в воздухе, загрязненном в результате производственной деятельности человека. Таким образом, окисление  до
до  с последующим образованием серной кислоты особенно интенсивно происходит в атмосфере городов и в районах промышленных предприятий[2].
с последующим образованием серной кислоты особенно интенсивно происходит в атмосфере городов и в районах промышленных предприятий[2].
Высокая растворимость  , образующейся в результате окисления сернистого газа, в воде определяет быстрое удаление серной кислоты из атмосферы с дождями. В результате проблема загрязнения атмосферы сернистым газом слилась с проблемой «кислых дождей». Возможные экологические последствия столь резкого окисления дождевых вод пока еще не вполне ясны. Беспокойство экологов, в частности, вызывает влияние кислых дождевых вод на растительность, связанное с интенсивным выщелачиванием почв. Было зафиксировано также резко отрицательное воздействие увеличения кислотности речной и озерной воды на рыбную фауну. Исследования по программе «Здоровье населения и система наблюдений за окружающей средой», выполнявшиеся в рамках ООН, показали, что вредное воздействие на здоровье населения в большой мере оказывают присутствующие в воздухе сульфаты, чем сернистый газ, не окисленный еще до состояния
, образующейся в результате окисления сернистого газа, в воде определяет быстрое удаление серной кислоты из атмосферы с дождями. В результате проблема загрязнения атмосферы сернистым газом слилась с проблемой «кислых дождей». Возможные экологические последствия столь резкого окисления дождевых вод пока еще не вполне ясны. Беспокойство экологов, в частности, вызывает влияние кислых дождевых вод на растительность, связанное с интенсивным выщелачиванием почв. Было зафиксировано также резко отрицательное воздействие увеличения кислотности речной и озерной воды на рыбную фауну. Исследования по программе «Здоровье населения и система наблюдений за окружающей средой», выполнявшиеся в рамках ООН, показали, что вредное воздействие на здоровье населения в большой мере оказывают присутствующие в воздухе сульфаты, чем сернистый газ, не окисленный еще до состояния 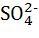 [2].
[2].
Галоиды
О распространении галоидов в атмосфере имеется очень мало данных. Исключением является хлор, присутствие которого в атмосфере находит отражение в варьирующих содержаниях хлор-иона в дождевых водах. Помимо ничтожной доли хлора, которая поступает в атмосферу с вулканическими газами, содержащими десятые доли процента этого элемента, весь хлор атмосферы является составной частью хлоридов, выдуваемых ветром с поверхностей морей и океана, и в меньшей степени из засоленных почв[6].
Присутствие фтора в атмосфере ничтожно. Некоторое увеличение его содержания ( в два – четыре раза превышающее геохимический фон ) отмечалось над рудными месторождениями, содержащими минералы фтора. Освобождение фтор-иона в данном случае, вероятно, является следствием взаимодействия серной кислоты, образующейся при окислении пирита с наиболее распространенным минералом фтора – флюоритом  . Техногенное загрязнение воздуха газообразными соединениями фтора HF и
. Техногенное загрязнение воздуха газообразными соединениями фтора HF и  обычно отмечается в радиусе нескольких километров от алюминиевых заводов и предприятий по производству суперфосфата. Содержание 1
обычно отмечается в радиусе нескольких километров от алюминиевых заводов и предприятий по производству суперфосфата. Содержание 1  фтора в воздухе губительно действует на некоторые растения. Предельно допустимыми максимальными концентрациями фтор-иона в воздухе являются 0,02 мг/м³ (разовая) и 0,005 мг/м³( среднесуточная)[6].
фтора в воздухе губительно действует на некоторые растения. Предельно допустимыми максимальными концентрациями фтор-иона в воздухе являются 0,02 мг/м³ (разовая) и 0,005 мг/м³( среднесуточная)[6].
Озон
Содержание озона  в атмосфере крайне незначительно. Подобно окислам азота озон образуется в атмосфере под действием электрических разрядов во время грозы ( молнии ), а так же синтезируются из кислорода под воздействием коротковолновой космической ультрафиолетовой радиации. В пределах атмосферы повышенные концентрации озона образуют так называемый озоновый слой, имеющий крайне важное значение для жизни на Земле. Нижняя граница озонового слоя располагается на высоте 15-25 км. Максимальная концентрация озона характерна для верхней приграничной зоны слоя, в пределах которой задерживается большая часть ультрафиолетового излучения и происходит синтез молекул озона. Если бы коротковолновое УФ-излучение в начальной его интенсивности достигло бы бисферы, то оно явилось бы губительным для жизни на Земле[3].
в атмосфере крайне незначительно. Подобно окислам азота озон образуется в атмосфере под действием электрических разрядов во время грозы ( молнии ), а так же синтезируются из кислорода под воздействием коротковолновой космической ультрафиолетовой радиации. В пределах атмосферы повышенные концентрации озона образуют так называемый озоновый слой, имеющий крайне важное значение для жизни на Земле. Нижняя граница озонового слоя располагается на высоте 15-25 км. Максимальная концентрация озона характерна для верхней приграничной зоны слоя, в пределах которой задерживается большая часть ультрафиолетового излучения и происходит синтез молекул озона. Если бы коротковолновое УФ-излучение в начальной его интенсивности достигло бы бисферы, то оно явилось бы губительным для жизни на Земле[3].
Играя столь важную для окружающей среды роль в стратосфере, повышенное содержание озона является крайне нежелательным на более низких уровнях, в тропосфере. Являясь сильнейшим окислителем, озон оказывает токсичное и разрушительное действие на живую материю. В тропосфере озон может возникать в результате превращения окислов азота и органического вещества. Таким образом, загрязнение тропосферы техногенными окислами азота в определенных условиях влечет за собой и нежелательное повышение содержания озона в окружающей среде[3].
Радон
Это инертный газ, являющийся продуктом распада изотопов радия, присутствующих в горных породах в крайне незначительном количестве. Период полураспада наиболее долгоживущего из изотопов радона  равен всего четырем дням, еще быстрее распадается два других изотопа
равен всего четырем дням, еще быстрее распадается два других изотопа  ( актинон) и
( актинон) и  ( торон). Таким образом, изотопы радона, мигрируя из горных пород в атмосферу, быстро распадаются и не успевают достичь ее высоких слоев[6].
( торон). Таким образом, изотопы радона, мигрируя из горных пород в атмосферу, быстро распадаются и не успевают достичь ее высоких слоев[6].
Ртуть
Ядовитые свойства ртути выделяют этот легколетучий металл в качестве опасного загрязнителя атмосферы. В результате естественных процессов на поверхность земного шара ежегодно поступает около 1000 т ртути. При этом считается, что поступление ртути в атмосферу из таких естественных источников, как вулканы ( в том числе грязевые ) и фумаролы, превышает количество техногенной ртути, выбрасываемой в воздух человеком, хотя имеющиеся данные недостаточны для такой оценки[5].
Как показали тщательные исследования, ртуть, поступающая в атмосферу, достаточно быстро удаляется из нее с дождевыми водами и просто гравитационным осаждением, обогащая таким образом почвы и гидросферу[5].
Источниками поступления техногенной ртути в атмосферу являются:
-сжигание твердого и жидкого органического топлива ( каменные угли содержат 0,05-13,3  ;
;
-металлургическая переработка руд цветных металлов, как правило, содержащих примеси ртути;
- частичное испарение летучих органических соединений ртути, образованных бактериями, из почв и осадков.
Практически вся ртуть в процессах переработки этих руд возгоняется в воздух. В результате суммарное поступление техногенной ртути в атмосферу, по всей вероятности, несколько превышает 1100 т/год ( без учета частичного испарения органических соединений ртути из почв и осадков, которое количественно оценить невозможно )[5].
|
из
5.00
|
Обсуждение в статье: Ксенокомпоненты атмосферы, включая антропогенные загрязнители. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

