 |
Главная |
Приготовление раствора по точной навеске вещества.
|
из
5.00
|
Количественный анализ
Методические указания
К выполнению лабораторных работ
САНКТ – ПЕТЕРБУРГ
Г
КОЛИЧЕСТВЕННЫЙ МЕТОД АНАЛИЗА
ТИТРИМЕТРИЧЕКИЙ АНАЛИЗ
Титриметрический анализ основан на точном измерении объема стандартного раствора реагента (титранта), израсходованного на реакцию с определяемым веществом.
В титриметрии используют реакции всех типов с переносом протона, электрона, электронной пары, а также процессы осаждения.
Таблица 1. Классификация и характеристика методов титриметрического анализа
| Метод | Протекающая реакция | Титранты |
| Нейтрализация, или кислотно-основное титрование | Нейтрализация | HCI, NaOH |
| Оксидиметрия, или окислительно-восстановительное титрование | Окисление-восстановление | KMnO4, K2Cr2O7, I2, Na2S2O3 |
| Комплексонометрия Осаждение | Комплексообразование Осаждение труднорастворимых солей | Трилон Б (НЭДТУ) AgNO3, KSCN |
Процесс медленного прибавления титранта к раствору определенного вещества называется титрованием.
Момент титрования, когда количество прибавленного титранта становится эквивалентным количеству определяемого вещества называется эквивалентной точкой титрования или точкой эквивалентности (ТЭ). Ее определяют с помощью индикатора или по изменению физико-химических характеристик титруемого раствора. Метод отличается быстротой и точностью получаемых результатов.
Реакция титрования должна отвечать следующим требованиям:
1. Быть строго стехиометрической.
2. Быстро протекать.
3. Протекать количественно, т.е. константа равновесия должна быть высокой.
4. Должен существовать способ фиксирования ТЭ.
Расчет результатов титриметрического анализа основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой в эквивалентных количествах (n1=n2). Таким образом n=сV·10-3, где с- молярная концентрация эквивалента, а V – объем, в котором растворено вещество, то для двух стехиометрических реагирующих веществ справедливо соотношение:
c1 V1=c2V2
Следовательно, можно найти неизвестную концентрацию одного из веществ (пусть с2), если известны объем его раствора и объем и концентрация прореагировавшего с ним вещества.
Зная молекулярную массу эквивалента М, находим массу вещества:
m2= c2MV0·10-3
Виды титрования.
По способу выполнения различают прямое, обратное и титрование заместителя.
Прямое титрование. В этом случае титрант непосредственно добавляют к титруемому веществу. Этот способ применяют только при выполнении всех перечисленных требований.
Обратное титрование. Если скорость реакции мала или не удается подобрать индикатор, или наблюдается, например, потери определяемого вещества вследствие летучести, то в этом случае используют прием обратного титрования: к определяемому веществу добавляют заведомый избыток титранта, доводят реакцию до конца, а затем находят количество не прореагировавшего титранта титрованием с другим реагентом известной концентрацией.
Пример.
 |
Прямое титрование диоксида Mn (IV) сульфатом железа невозможно из-за малой скорости реакции:
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
Поэтому навеску MnO2 обрабатывают раствором FeSO4, взятом в заведомом избытке, нагревают до полного завершения реакции. Затем не прореагировавший Fe2+ оттитровывают стандартным раствором K2Cr2O7.
Титрование по замещению. Если реакция нестехиометрична или протекает медленно используют титрование заместителя.
Для этого проводят стехиометрическую реакцию определяемого вещества с вспомогательным реагентом, а получающийся в эквивалентном количестве продукт оттитровывают титрантом.
Пример. Взаимодействие дихромат (Сr2О72- ) и тиосульфат– ( S2O32-) ионов протекает нестехиометрично. Поэтому к раствору, содержащему (Cr2O72-) добавляют раствор иодида калия, реагирующего с ним стехиометрично:
Cr2O72- + 6J- +14H+=2Cr3++3J2+7H2O.
Выделившийся в эквивалентном количестве дихромату иод оттитровывают раствором тиосульфата натрия по реакции:
J2+2S2O32-=2J-+S4O62-.
Иногда приходится проводить несколько последовательных реакций замещения.
Стандартные растворы
Для титриметрического определения необходимо, чтобы раствор титранта был стандартизирован. Под стандартизацией раствора титранта имеют в виду установление его точной концентрации с относительной погрешностью, обычно не превышающей – 0,1%. Титрант с известной концентрацией называют стандартным раствором. По способу приготовления различают первичные и вторичные стандартные растворы.
Первичный стандартный раствор готовят растворением точного количества чистого химического вещества известного стехиометрического состава в определенном объеме растворителя. Вторичный стандартный раствор получают следующим образом: готовят раствор с приблизительной концентрацией, близкой к желаемой, и определяют его концентрацию (стандартизируют) по подходящему первичному стандартному раствору.
Для приготовления многих стандартных растворов можно воспользоваться фиксаналами. Фиксанал представляет собой ампулу, в которой запаяно точно известное количество стандартного вещества или раствора. Для приготовления раствора известной концентрации нужно разбить ампулу над специальной воронкой с пробивным устройством, перенести содержимое ампулы в мерную колбу подходящего объема и разбавить водой до метки. Однако, чтобы застраховаться от случайных погрешностей, следует стандартизировать даже приготовленный таким образом раствор и периодически повторять стандартизацию (за исключением тех случаев, когда известно, что раствор совершенно устойчив).
Способы выражения концентрации стандартных растворов. Обычно концентрацию растворов выражают в молях эквивалентов вещества в 1 л раствора (молярная концентрация эквивалента). Иногда используют также титр по исходному веществу: это количество граммов стандартного вещества в 1 мл раствора. При проведении однотипных тит-риметрических определений удобен титр по определяемому веществу — масса определяемого вещества, с которой реагирует 1 мл стандартного раствора. Например, ТНCI/CaCO3, = 0,008 г/мл означает, что 1 мл раствора
НCI реагирует с 0,008 г СаСО3. 
Техника выполнения титриметрического анализа
Приготовление раствора по точной навеске вещества.
Молярные растворы. Для приготовления 1 л 1 М раствора вещества подсчитывают его молекулярную массу и вычисляют массу навески по формуле:
g = 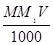 , (1)
, (1)
где g — навеска вещества, г; М — молекулярная масса, г; М1 — требуемая молярность раствора; V— вместимость мерной колбы, мл.
Вычисленную навеску взвешивают на аналитических весах на часовом стекле с точностью до 0,0001 г и переносят ее в чистую мерную колбу небольшими порциями (обычно для этого используют чистую сухую воронку). Часовое стекло и воронку промывают 3—5 раз дистиллированной водой из промывалки. Затем колбу заполняют дистиллированной водой на 1/2 ее объема и встряхивают до полного растворения вещества. После этого содержимое колбы доводят до метки водой и тщательно перемешивают.
Пример. Приготовить 0,5 л 0,2 М раствора АgNO3.
Вычисляют молекулярную массу нитрата серебра: 169,875. Подставив это значение в формулу (1), получают массу необходимой навески:
g = 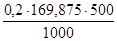 =16,9875.
=16,9875.
Нормальные растворы. Навеску вычисляют по формуле:
g = 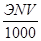 , (2)
, (2)
где Э — эквивалентная масса вещества, г; N — требуемая нормальность раствора; V— вместимость мерной колбы, мл,
Значение Э находят в табл: 114. Вычисленную навеску взвешивают и растворяют, как описано выше.
Пример. Рассчитать навеску перманганата калия для приготовления 2 л 0,1 н. раствора.
При титровании в кислой среде ЭКМп04 = 158,03/5 = 31,61 г. Подставив эту величину в формулу (2), получают:
g = 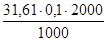 = 6,322 г.
= 6,322 г.
|
из
5.00
|
Обсуждение в статье: Приготовление раствора по точной навеске вещества. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

