 |
Главная |
ВЫПОЛНЕНИЕ КОНТРОЛЬНЫХ РАБОТ
|
из
5.00
|
Ч а с т ь 2
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Учебно-методическое пособие для студентов
инженерно-технических специальностей
Безотрывной формы обучения
Гомель 2008
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
“БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ТРАНСПОРТА”
Кафедра физики
ФИЗИКА
Ч а с т ь 2
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Учебно-методическое пособие для студентов
инженерно-технических специальностей
Безотрывной формы обучения
Гомель 2008
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
“БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ТРАНСПОРТА”
Кафедра физики
ФИЗИКА
Ч а с т ь 2
МОЛЕКУЛЯРНАЯ ФИЗИКА
И ТЕРМОДИНАМИКА
Учебно-методическое пособие для студентов
инженерно-технических специальностей
безотрывной формы обучения
Одобрено методической комиссией строительного факультета
Гомель 2009
УДК 53 (075.8)
ББК 22.3
П90
Р е ц е н з е н т – доктор техн. наук, профессор О. В. Холодилов
( УО “БелГУТ ” )
Проневич И. И.
П81 Физика : учеб.-метод. пособие для студентов инж.-техн. специальностей безотрывной формы обучения: в 6 ч. Ч. 2. Молекулярная физика и термодинамика / И. И. Проневич, Р. Г. Пинчук, И.В. Приходько, В. Я. Матюшенко ; М-во образования Респ. Беларусь, Белорус. гос. ун-т трансп. – Гомель : БелГУТ, 2008. – c.
ISBN-978-985-468-334-8
Приведены общие методические указания, вопросы для изучения теоретического материала по разделам программы, основная и дополнительная литература, сведения из теории, примеры решения задач, задачи для контрольных работ и справочные таблицы по разделу "Молекулярная физика и термодинамика" программы курса физики.
Предназначено для методического обеспечения самостоятельной работы по физике студентов инженерно-технических специальностей безотрывной формы обучения.
УДК 53 (075.8)
ББК 22.3
ISBN -978-985-468-334-8 © Проневич И. И., Пинчук Р. Г., Приходько И.В., Матюшенко В. Я., 2009
© Оформление. УО “БелГУТ”, 2009
ОБЩИЕ МЕТОДИЧКСКИЕ УКАЗАНИЯ
Курс физики втузов делится на шесть разделов. В соответствии с этим учебный материал пособия разделен на три части, которые включают в себя по два раздела курса. Изучение каждого раздела сопровождается выполнением одной контрольной работы из восьми задач. Варианты задач контрольных работ выдаются преподавателем в конце соответствующей экзаменационной сессии.
Процесс изучения курса физики студентом безотрывной формы обучения состоит из следующих основных этапов: самостоятельное изучение физики по учебной литературе, решение задач, выполнение контрольных работ и их защита преподавателю, выполнение лабораторных работ, сдача зачетов и экзаменов.
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО УЧЕБНОЙ ЛИТЕРАТУРЕ
Этот вид занятий является главным в учебной работе студента безотрывной формы обучения. При этом необходимо руководствоваться следующим:
1 Курс физики необходимо изучать систематически в течение всего учебного процесса. Изучение курса в сжатые сроки перед экзаменом не дает глубоких и прочных знаний.
2 Избрав какой-нибудь учебник в качестве основного, студент должен придерживаться его при изучении всего курса или, по крайней мере, целого раздела. Замена одного учебника другим в процессе изучения ведет к утрате логической связи между отдельными вопросами. Если же основное пособие не дает полного ответа на отдельные вопросы программы, необходимо обратиться и к другой учебной литературе.
3 Работа над учебником сопровождается составлением конспекта, в котором записываются формулировки законов и выражающие их формулы, определения физических величин и единиц их измерения, выполняется чертеж и решаются типовые задачи.
4 Изучая курс физики, студент встречается с большим количеством единиц измерения, которые объединяются в Международную систему единиц (СИ). Студент должен помнить, что без основательного знания системы единиц, без умения пользоваться ими при решении физических задач невозможно усвоить курс физики и тем более применять физические знания на практике.
Студент не должен ограничиваться только запоминанием физических формул. Он должен осмыслить их и уметь самостоятельно вывести.
РЕШЕНИЕ ЗАДАЧ
Необходимым условием успешного изучения курса общей физики является систематическое решение задач, которое помогает уяснить физический смысл явлений, закрепить в памяти студента формулы, выработать навыки практического применения теоретических знаний.
При решении задач необходимо:
1 Выбрать основные законы и формулы, которые используются при решении задачи, их формулировку, разъяснить буквенные обозначения, употребляемые при написании формул.
2 Сопровождать решение краткими исчерпывающими пояснениями.
3 Все величины, входящие в условие задачи, выразить в единицах СИ. Проверить размерность искомой величины, для этого подставить в правую часть полученной формулы вместо обозначений величин наименования их единиц и проверить, получается ли в результате единица искомой величины; верно полученная рабочая формула должна давать правильную размерность искомой величины.
4 В окончательную формулу, полученную в результате решения задачи в общем виде, подставить числовые значения, выраженные в единицах одной системы (СИ). Пренебрежение этим правилом приводит к неверному результату.
5 Произвести вычисления величин, подставленных в формулу, руководствуясь правилами приближенных вычислений, при необходимости– представлять результат в виде степенного числа. Записать в ответе числовое значение и размерность единицы измерения искомой величины в СИ.
6 Оценить правдоподобность полученного результата.
Физические задачи весьма разнообразны, и дать единую схему их решения невозможно. Однако, как правило, физические задачи следует решать в общем виде, т. е. в буквенных выражениях, не производя вычисления промежуточных величин. Числовые значения подставляются только в окончательную рабочую формулу, выражающую искомую величину. Умение решать задачи приобретается длительными и систематическими упражнениями.
ВЫПОЛНЕНИЕ КОНТРОЛЬНЫХ РАБОТ
Выполнение контрольных работ студентом и их рецензирование преследует две цели: во-первых, таким путем осуществляется контроль за самостоятельной работой студента; во-вторых, проверяется усвоение студентом соответствующего материала с целью оказать при необходимости ему помощь по вопросам, которые оказались слабо усвоены или не поняты студентом.
По каждому разделу курса общей физики студент-заочник приступает к выполнению контрольных работ только после изучения материала, соответствующего данному разделу программы, внимательного ознакомления с приемами решения задач, приведенных в данном пособии по каждому разделу курса.
При этом необходимо руководствоваться следующим :
1 Контрольные работы от первой до последней выполняются в обычной школьной тетради (каждая контрольная работа в отдельной тетради), только по условиям задач данного пособия. Замена какой-либо контрольной работы другой, взятой из аналогичного пособия, не допускается.
2 На лицевой стороне контрольной работы приводятся сведения по следующему образцу:
 Кафедра физики
Кафедра физики
Контрольная работа № __ по физике
(задачи № )
студента __ курса (группа ______ ) Иванова Ивана Ивановича
Учебный шифр № ______________
246028, г. Гомель, ул. им. Кожара, д. 27, кв. 15
3 Выполнять контрольные работы следует чернилами или шариковой ручкой. Каждая следующая задача должна начинаться с новой страницы. Условие задачи переписывается полностью, без сокращений. Для замечаний рецензента на страницах тетради оставляются поля.
4 Все решаемые задачи сопровождаются краткими, но исчерпывающими пояснениями, раскрывающими физический смысл употребляемых формул, и с обязательным выполнением основных правил решения задач.
5 В конце каждой контрольной работы студент-заочник должен привести название учебника или учебного пособия, которым он пользовался, автора и год издания, чтобы рецензент в случае необходимости мог конкретно указать, что следует студенту изучить для завершения контрольной работы.
6 Получив прорецензированную работу, студент обязан устранить недостатки, указанные рецензентом.
7 Если при рецензировании контрольная работа не зачтена, студент обязан послать ее на повторное рецензирование, включив в нее дополнительные решения тех задач, в которых были допущены ошибки. Работа над ошибками выполняется в той же тетради (в конце контрольной работы).
8 Студент является на экзаменационную сессию, получает на кафедре прорецензированные работы и по расписанию деканата защищает их преподавателю. Студент должен быть готов при защите контрольной работы дать пояснения по существу решения входящих в нее задач. Зачтенные контрольные работы остаются у экзаменатора.
ВОПРОСЫ ДЛЯ ИЗУЧЕНИЯ ТЕОРЕТИЧЕСКОГО МАТЕРИАЛА ПО РАЗДЕЛАМ ПРОГРАММЫ
Введение. Кинематика материальной точки. Механическое движение. Система отсчета. Траектория. Перемещение и путь. Скорость и ускорение. Тангенциальное и нормальное ускорение. Движение материальной точки по окружности. Связь между линейными и угловыми характеристиками движения.
Динамика материальной точки и тела, движущегося поступательно. Первый закон Ньютона. Инерциальные системы отсчета. Сила, масса. Второй закон Ньютона. Третий закон Ньютона. Импульс. Закон сохранения импульса.
Силы в механике. Виды сил в механике. Силы упругости. Силы трения. Силы тяжести. Закон всемирного тяготения. Гравитационное поле и его характеристики. Понятие об неинерциальных системах отсчета.
Работа. Мощность. Консервативные и неконсервативные силы. Потенциальная энергия. Кинетическая энергия. Закон сохранения энергии в механике.
Динамика вращательного движения твердого тела. Модель абсолютно твердого тела. Поступательное и вращательное движения тела. Центр инерции (масс) твердого тела. Момент инерции. Момент импульса. Момент силы. Основной закон механики вращательного движения. Закон сохранения момента импульса. Кинетическая энергия вращательного движения тела.
Релятивистская механика. Преобразования Галилея. Механический принцип относительности. Границы применимости классической механики. Постулаты Эйнштейна. Принципы относительности Эйнштейна. Преобразования Лоренца. Следствия, вытекающие из преобразований Лоренца (одновременность событий, сокращение длин и промежутков времени, релятивистский закон сложения скоростей). Релятивистская масса и импульс. Основной закон релятивистской динамики. Понятие энергии в релятивистской механике (энергия покоя, кинетическая, полная).Взаимосвязь массы и энергии.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Основная
1 Савельев, И. В. Курс общей физики : учеб. пособие для студентов втузов в 3 т. / И. В. Савельев. – 3-е изд., испр. – М. : Наука. Гл. ред. физ.-мат. лит., 1987. – Т. 3 : Квантовая оптика. Атомная физика. Физика твердого тела. Физика атомного ядра и элементарных частиц – 320 с.
2 Детлаф, А. А.Курс физики : учеб. пособие для втузов / А. А. Детлаф, Б. М. Яворский. – М. : Высш. шк., 1989. – 608 с.
3 Трофимова, Т. И. Курс физики : учеб. пособие для вузов / Т. И. Трофимова. – 4-е изд., перераб. и доп. – М. : Высш. шк., 1997. – 542 с.
4 Трофимова, Т. И. Сборник задач по курсу физики для втузов : учеб. пособие для вузов / Т. И. Трофимова. – 3-е изд. – М. : ОНИКС-21 век; Мир и Образование, 2005. – 383 с.
5 Чертов, А. Г. Задачник по физике : учеб. пособие для втузов / А. Г. Чертов, А. А. Воробьев. – 5-е изд., перераб. и доп. – М. : Высш. шк., 1988. – 526 с.
Дополнительная
1 Ландсберг, Г. С. Оптика : учеб. пособие для студ. физ. спец. вузов / Г. С. Ландсберг. – 5-е изд., перераб. и доп. – М. : Наука, 1976. – 926 с.
2 Волькенштейн, В. С. Сборник задач по общему курсу физики / В. С. Волькенштейн. – 11-е изд., перераб. – М. : Наука, 1985. – 381 с.
3 Савельев, И. В. Сборник задач и вопросов по общей физике : учеб. пособие / И. В. Савельев. – 2-е изд., перераб. – М. : Наука, 1988. – 288 с.
4 Чертов, А. Г. Физические величины: (Терминология, определения, обозначения, размерности, единицы) / А. Г. Чертов. – М. : Высш. шк., 1990. – 334 с.
5 Сена, Л. И. Единицы физических величин и их размерности : учеб. пособие для студ. вузов / Л. И. Сена. – 2-е изд., перераб. и доп. – М. : Наука, 1977. – 335 с.
6 Яворский, Б. М. Справочник по физике / Б. М. Яворский, А. А. Детлаф. – 3-е изд., испр. – М. : Наука. Гл. ред. физ.-мат. лит., 1990. – 624 с.
7 Кухлинг, Х. Справочник по физике : [пер с нем.] / Х. Кухлинг ; под ред. Е. М. Лейкина. – М. : Мир, 1982. – 520 с.
8 Сборник задач по физике / под общ. ред. М. С. Цедрика. – 2-е изд., перераб. – Мн. : Выш. шк., 1976. – 320 с.
9 Физика: задания к практическим занятиям / под ред. Ж. П. Лагутиной. – 2-е изд., перераб. и доп. – Мн. : Выш. шк., 1989. – 236 с.
10 Новодворская, Е. М. Методика проведения упражнений по физике во втузе / Е. М. Новодворская, Э. М. Дмитриева. – 3‑е изд., перераб. и доп. – М. : Высш. шк., 1981. – 318 с.
11 Иродов, И. Е. Задачи по общей физике : учеб. пособие / И. Е. Иродов. – 2-е изд., перераб. – М. : Наука. Гл. ред. физ.-мат. лит., 1988.– 416 с.
12 Фирганг, Е. В. Руководство к решению задач по курсу общей физики : учеб. пособие для студ. втузов / Е. В. Фирганг. – М. : Высш. шк., 1978. – 351 с.
13 Козел, С. М. Сборник задач по физике : учеб. пособие / С. М. Козел, Э. И. Рашба, С. А. Славатинский. – 2-е изд., перераб. и доп. – М. : Наука. Гл. ред. физ.-мат. лит., 1987. – 304 с.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Молекулярно-кинетическая теория идеальных газов
Количество однородного вещества (в молях)
 ,
,
где N – число молекул; NА – постоянная Авогадро; m – масса; m – – молярная масса вещества.
Если система представляет собой смесь нескольких газов, то количество вещества системы
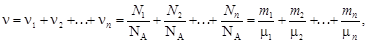
где ni, Ni, mi, mi – соответственно количество вещества, число молекул, масса, молярная масса i-й компоненты смеси.
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
 ,
,
где р – давление; V – объем; m – масса; m – молярная масса газа; R – универсальная газовая постоянная; n – количество вещества; Т – термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения состояния для изопроцессов:
а) Закон Бойля-Мариотта (изотермический процесс – Т = const, m = = const):
pV = const,
или для двух состояний газа:
р1V1 = p2V2;
б) закон Гей-Люссака (изобарный процесс – p = const, m = const):
 ;
;
в) закон Шарля (изохорный процесс – V =const, m = const):
 ;
;
г) объединённый газовый закон (m = const):

где р1, V1, Т1 – давление, объём и температура газа в начальном состоянии; р2, V2, Т2 – те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси n идеальных газов,
p = p1 + p2 + ... + pn,
где pi – парциальное давление i-й компоненты смеси. Парциальным называется давление, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси n газов
 ,
,
где mi и ni – масса и количество вещества 1-го компонента смеси.
Концентрация молекул

где N – число молекул в системе; V – объем системы; r – плотность вещества; NA – число Авогадро.
Формула справедлива для любого состояния вещества.
Зависимость давления газа от концентрации молекул и температуры
p = nkT,
где k – постоянная Больцмана.
Основное уравнение молекулярно-кинетической теории идеальных газов
 ,
,
где n – концентрация молекул; m0 – масса одной молекулы; m – масса газа в объёме V; <vкв> – средняя квадратичная скорость молекул; <e> – средняя кинетическая энергия поступательного движения молекул; Е – суммарная кинетическая энергия поступательного движения всех молекул.
Закон Максвелла распределения молекул идеального газа по скоростям

где f(v) – функция распределения молекул по скоростям, определяющая долю числа молекул, скорости которых лежат в интервале от v до v + dv.
Число молекул, относительные скорости которых заключены в пределах от u до u + du,

где u = v/vв – относительная скорость, равная отношению скорости молекул v к наивероятнейшей скорости vв; f(u) – функция распределения по относительным скоростям.
Распределение молекул по энергиям. Число молекул, энергии которых заключены в интервале от e до e + de,

где f(e) – функция распределения по энергиям.
Скорость молекул:
наиболее вероятная –  ;
;
средняя квадратичная – 
средняя арифметическая – 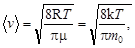
где m0 – масса молекулы.
Средняя кинетическая энергия поступательного движения молекулы

Средняя полная кинетическая энергия молекулы
 ,
,
где i – число степеней свободы молекулы.
Барометрическая формула
 ,
,
где рh и р0 - давление газа на высоте h и h0.
Распределение Больцмана во внешнем потенциальном поле
 ,
,
где n – концентрация частиц; n0 – концентрация частиц в точках, где U = 0. U – их потенциальная энергия.
Cреднее число соударений, испытываемых молекулой газа за 1 с,
 ,
,
где d – эффективный диаметр молекулы; n – концентрация молекул; ávñ – средняя арифметическая скорость молекулы.
Средняя длина свободного пробега молекул газа
 .
.
Импульс, переносимый молекулами из одного слоя газа в другой через элемент поверхности площадью DS за время dt,
 ,
,
где h – динамическая вязкость газа; dv/dz – поперечный градиент скорости течения его слоев.
Динамическая вязкость

где r – плотность газа (жидкости).
Закон Ньютона для силы внутреннего трения (вязкости) между слоями площадью DS
 .
.
Закон теплопроводности Фурье

где DQ – теплота, прошедшая посредством теплопроводности через площадку S за время Dt; dT/dx – градиент температуры; l – теплопроводность, для газов

сv – удельная теплоёмкость газа при постоянном объёме; r – плотность газа; ávñ и álñ – средняя арифметическая скорость и средняя длина свободного пробега молекул.
Закон диффузии Фика

где Dm – масса вещества, переносимая в результате диффузии через поверхность площадью S за время Dt; d r/dх – градиент плотности; D – коэффициент диффузии; для газов

Основы термодинамики
Молярная теплоёмкость газа при постоянном объёме и постоянном давлении соответственно

где i – число степеней свободы; R – универсальная газовая постоянная.
Связь между удельной (с) и молярной (Сm) теплоёмкостями
Сm = сm,
где m – молярная масса.
Уравнение Майера
Срm – СVm = R.
Внутренняя энергия идеального газа
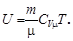
Уравнение адиабатного процесса (уравнение Пуассона)
pV g = const, TV g-1 = const, Tgp1-g = const,
где g – показатель адиабаты,

Уравнение политропы
рVn = const,
где n = (C – Cp) / (C – CV) – показатель политропы.
Работа, совершаемая газом при изменении его объёма, в общем случае вычисляется по формуле

где V1 и V2 – начальный и конечный объемы газа.
Работа при изобарическом процессе (р = const)
A = p (V2 – V1),
при изотермическом (Т = const) –

при адиабатном (Q = const) –

при политропном (C = const) –

где Т1, Т2, V1, V2, p1, p2 – соответственно начальные и конечные температура, объём и давление газа.
Первое начало термодинамики
Q = DU + A,
где Q – количество теплоты, сообщённое газу; DU – изменение его внутренней энергии; А – работа, совершённая газом против внешних сил.
Первое начало термодинамики при изобарическом процессе

при изохорном (А = 0 ) –

при изотермическом (DU = 0) –

при адиабатическом (Q = 0) –

Термический коэффициент полезного действия для кругового процесса (цикла)

где Q1 – количество теплоты, полученное системой; Q2 – количество теплоты, отданное системой; А – работа, совершаемая за цикл.
КПД цикла Карно

где Т1 – температура нагревателя; Т2 – температура холодильника.
Холодильный коэффициент машины, работающей по обратному циклу Карно,

где Qотв – количество теплоты, отведённое из холодильной камеры; А – совершённая работа; Т2 – температура более холодного тела (холодильной камеры); Т1 – температура более горячего тела (окружающей среды).
Изменение энтропии при равновесном переходе системы из состояния 1 в состояние 2

Изменение энтропии идеального газа

Уравнение Ван-дер-Ваальса

где р – давление; m – масса; m – молярная масса; a и b – постоянные Ван-дер-Ваальса; V – объем; Т – термодинамическая температура.
Связь критических параметров – объема, давления и температуры газа – с постоянными Ван-дер-Ваальса:

Внутренняя энергия реального газа

Коэффициент поверхностного натяжения
 ,
,
где F – сила поверхностного натяжения, действующая на контур длиной  , ограничивающий поверхность жидкости.
, ограничивающий поверхность жидкости.
При изотермическом увеличении площади поверхности плёнки жидкости на DS совершается работа
А = a DS.
Добавочное давление Dр, вызванное кривизной поверхности жидкости, выражается формулой Лапласа

где R1 и R2 – радиусы кривизны двух взаимно перпендикулярных сечений поверхности жидкости.
В случае сферической поверхности
Dр = 2 a / R.
Высота поднятия жидкости в капиллярной трубке

где q – краевой угол; r – плотность жидкости; g – ускорение свободного падения; r – радиус трубки.
Высота поднятия жидкости в зазоре между двумя близкими и параллельными плоскостями
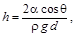
где d – расстояние между плоскостями.
Уравнение Клапейрона-Клаузиуса

где u1 и u2 – удельные объёмы вещества в двух фазовых состояниях; Т и р – температура и давление фазового перехода; q12 – удельная теплота фазового перехода вещества.
Закон Дюлонга и Пти: молярная теплоемкость Сm химически простых твердых тел
Сm = 3R,
где R – универсальная газовая постоянная.
Закон Неймана- Коппа: молярная теплоемкость Сm химически сложных твердых тел( состоящих из различных атомов)
Сm = n×3R,
где n – общее число частиц в химической формуле соединения; R – универсальная газовая постоянная.
При нагревании тела от 0 °С до t °C его длина (в первом приближении) изменяется от l0 до l по закону
l= l0 (1+ al t),
где al – коэффициент линейного расширения.
При нагревании тела от 0 °С до t °C его объем изменяется от V0до V по закону
V= V0 (1+av t),
где av– коэффициент объемного расширения(av » 3al ).
4 ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Найти молярную массу смеси кислорода массой m1 = 25 г и азота массой m2 = 75 г.
| Д а н о: m1 = 25 г m2 = 75 г mсм – ? |
Решение. Молярная масса смеси есть отношение массы смеси mсм к количеству вещества смеси, т.е.
mсм = mсм / nсм. (1)
Масса смеси равна сумме масс компонентов смеси:
mсм = m1 + m2,
количество вещества смеси
nсм = n1 + n2 = m1 / m1 + m2 / m2.
Подставив в формулу (1) выражения для mсм и nсм, получим

После вычислений найдем mсм = 30 × 10-3 кг/моль.
Пример 2. В баллоне вместимостью V = 10 л находится гелий под давлением р1 = 1 МПа и при температуре Т1 = 300 К. После того как из баллона было взято m = 10 г гелия, температура в баллоне понизилась до Т2 = 290 К. Определить давление р2 гелия, оставшегося в баллоне.
| Д а н о: V = 10 л р1= 1 МПа Т1 = 300 К Т2 = 290 К р2 – ? |
Решение. Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, применив его к конечному состоянию газа:

где m2 – масса гелия в баллоне в конечном состоянии; m – молярная масса гелия; R – универсальная газовая постоянная.
Выразим искомое давление:
р2 = m2RT2 / (mV). (1)
Массу m2 гелия выразим через массу m1, соответствующую начальному состоянию газа, и массу гелия, взятого из баллона
m2 = m1 – m. (2)
Масса m1 гелия также находится из уравнения Менделеева-Клапейрона для начального состояния гелия
m1 = mp1V / (RT1). (3)
Подставив выражения масс (2) и (3) в (1), найдём

Проверим, даёт ли полученная формула единицу давления. Для этого в её правую часть вместо символов величин подставляем их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них даёт единицу давления, т.к. первый сомножитель (Т2 / Т1) – безразмерный, а второй – давление. Проверим второе слагаемое:

Паскаль является единицей давления. Производим вычисления, учитывая, что m = 4×10-3кг/моль. Получим р2 = 0,364 МПа.
Пример 3. Найти среднюю кинетическую энергию движения одной молекулы кислорода при температуре Т = 350 К, а также кинетическую энергию движения всех молекул кислорода массой m = 4 г.
| Д а н о: m = 4 кг Т = 350 К <e> – ? Ек – ? |
Решение. На каждую степень свободы молекулы газа приходится одинаковая средняя энергия <ei> = = 1 / 2kT, где k – постоянная Больцмана, Т – термодинамическая температура газа. Поступательному движению двухатомной молекулы кислорода соответствуют три степени свободы, вращательному – две. Тогда средняя кинетическая энергия движения молекулы
<e> = 5 / 2 kT. (1)
Кинетическая энергия движения всех молекул газа
Ек = N <e>. (2)
Число всех молекул газа
N = nNA = NА m / m. (3)
Подставив выражение N в формулу (2), получаем
Ек= 5kTNА m /(2m) = 5RTm /(2m). (4)
Произведём вычисления, учитывая, что для кислорода m = 32×10-3 кг/моль:
<e> = 1,21×10-20 Дж; Ек = 910 Дж.
Пример 4. Используя функцию распределения молекул идеального газа по относительным скоростям, определить число молекул, скорости которых меньше 0,002 наиболее вероятной скорости, если в объёме газа содержится N = 1,67×1024 молекул.
| Д а н о: vm = 0,002 vв N = 1,67×1024 DN – ? |
Решение. Число dN(u) молекул, относительные скорости которых заключены в пределах от u до u + du,

гдеN – число молекул в объёме газа.
По условию задач vm = 0,002 vв, следовательно, umax = vmax / vв = 0,002, Так как u << 1, то exp(-u2) » 1 – u2. Пренебрегая u2 << 1, выражение для dN(u) можно записать в виде

Проинтегрировав данное выражение по u в пределах от 0 до umax, найдём

Вычисляя, получаем DN = 1016 молекул.
Пример 5. Вычислить удельные теплоёмкости при постоянном объеме и постоянном давлении неона и водорода, принимая эти газы за идеальные. Рассчитать также удельные теплоемкости смеси указанных газов, если массовые доли неона и кислорода составляют 80 и 20 % соответственно.
| Д а н о: m1 = 20×10-3 кг/моль m2 = 2×10-3 кг/моль. m1 = 2,5 кг m2 = 1,5 кг v1 = 6 м/с v2 = 2 м/с cv1 – ? с v2 – ? ср1– ? ср2– ? cv – ? ср – ? |
Решение. Удельные теплоёмкости идеальных газов определяются по формулам

Для неона (одноатомный газ) число степеней свободы i = 3 и m1 = 20 × 10-3 кг/моль. Поэтому
сv1 = 3 × 8,31 / (2 × 20 × 10-3) = 624 Дж/(кг×К), сp1 = 1040 Дж /(кг × К).
Для водорода (двухатомный газ) i = 5 и m2 = 2×10-3 кг/моль.
cv2 = 1,04 × 104 Дж /(кг × К), ср2 = 1,46 × 104 Дж /(кг × К).
Удельную теплоёмкость смеси при постоянном объёме сv найдём следующим образом. Теплоту, необходимую для нагревания смеси на DТ, выразим двумя способами:
Q = cv (m1 + m2) DТ, (1)
Q = (cv,1m1 + cv,2 m2)DT. (2)
Приравнивая правые части (1) и (2) и разделив обе части полученного равенства на DТ, получим
сv(m1 + m2) = cv,1m1 + cv,2m2.
Отсюда  или сv = c v,1w1 + c v,2w2,
или сv = c v,1w1 + c v,2w2,
где w1 = m1 / (m1 + m2) и w2 = m2 / (m1 + m2).
Рассуждая так же, получим формулу для вычисления удельной теплоёмкости смеси при постоянном давлении
ср = cр,1w1 + cр,2w2.
Произведём вычисления:
сv = (6,24 × 102 × 0,8 + 1,04 × 104 × 0,2) = 2580 Дж/(кг×К);
ср = (1,04 × 102 × 0,8 + 1,46 × 104 × 0,2) = 3752 Дж/(кг×К).
Пример 6. Некоторая масса кислорода при давлении р1 = 105 Па занимает объем V1 =10 л. Газ был нагрет сначала при постоянном давлении до объема V2 = 30 л, а затем при постоянном объеме до давления р2= = 0,5 МПа. Найти изменение внутренней энергии газа DU1a2, совершенную им работу А1а2 и количество поглощенной газом теплоты Q1а2. Произвести аналогичные расчёты в случае обратного следования процессов: сначала по изохоре, потом по изобаре (рисунок 1 кривая 1в2). Сравнить результаты расчётов в обоих случаях.

| Д а н о: р1 = 105 Па V1 =10 л V2 = 30 л р2= 0,5 МПа DU1a2- ? А1а2 -? Q1а2 -? DU1 b2- ? А1 b2 -? Q1 b2 -? |
Решение. Физическую систему составляет
|
из
5.00
|
Обсуждение в статье: ВЫПОЛНЕНИЕ КОНТРОЛЬНЫХ РАБОТ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

