 |
Главная |
Метод фиксированного времени
|
из
5.00
|
В методе фиксированного времени определяют концентрацию одного из участников реакции за строго определенный промежуток времени. Если, например, продукт реакции окрашен, через определенный промежуток времени измеряют оптическую плотность раствора. При небольшой глубине протекания реакции применяют дифференциальный вариант. Из уравнения (18) получаем
C = x / χat = (1/χat) x,
где t – заданный промежуток времени.
Выражение в скобках постоянно, так как а и t фиксированы. Его числовое значение может быть использовано для последующих расчетов ск по измеренной величине х. Практически можно поступать следующим образом. Готовят серии растворов с переменной и известной концентрацией СА ( при СВ = const), измеряют через определенный промежуток времени (t = const) количество прореагировавшего вещества х и строят градуировочный график (рис.3), откладывая на оси ординат х, а на оси абсцисс – концентрацию СА. По этому графику легко установить затем концентрацию СА в анализируемом растворе, поставив аналогичный эксперимент с раствором, в котором содержание СА неизвестно. Вполне понятно, что фиксированный отрезок времени сохраняется один и тот же как при построении градуировочного графика, так и при анализе неизвестного раствора. При большой глубине протекания реакции применяется интегральный вариант, основанный на решении уравнения (19) относительно ск. Метод фиксированного времени, как видно, проще метода тангенсов, однако по точности он ему уступает.
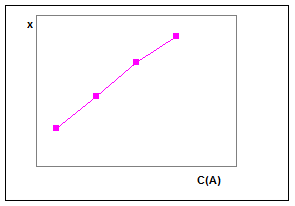 |
Рис.3. Градуировочный график в методе фиксированного времени.
Метод фиксированной концентрации
В методе фиксированной концентрации измеряют время, в течение которого концентрация продукта реакции или одного из реагирующих веществ достигает определенного, заранее заданного значения. Этот метод по сути близок методу фиксированного времени. Если глубина протекания реакции невелика, используют дифференциальный вариант, так же как и в методе фиксированного времени, основаной на решении уравнения (18) относительно ск:
Ck = x / χat = ( x / χa) 1/t, (20)
где х – заданная концентрация продукта реакции.
Выражение в скобках постоянно, поскольку постоянны х и а, его числовое значение может быть определено по стандартному раствору. Градуировочный график в методе фиксированной концентрации, как показывает уравнение (20) , следует строить в координатах ск - 1/t , где ск – определяемая концентрация, а t – время, необходимое для достижения заданной концентрации продукта реакции.
При более глубоком протекании реакции испльзуется интегральный вариант, основанный на решении уравнения (19):
Ck = (ln a / (a – x) 1/χ) 1 /t.
Градуировочный график, как видно, следует строить также в координатах ск - 1/t. По точности метод фиксированной концентрации близок к методу фиксированного времени и уступает методу тангенсов.
Метод добавок
Этот метод обладает известными достоинствами. Сначала оапределяют скорость химической реакции в анализируемом растворе, содержащем определяемый компенент неизвестной концентрации сх , а затем в анализируемые раствор добавляют точно известное количество определяемого компонента и вновь измеряют скорость реакции.
Метод каталиметрического титрования
Сущность этого метода можно пояснить на примере церий-арсенитной реакции, которая катализируется осмием, рутением и иодидом:
2Ce(SO4)2 + HAsO2 + 2H2O = Ce2(SO4)3 + H3AsO4 + H2SO4
Так как иодид является катализатором реакции церия с арсенитом, скорость этой реакции будет возрастать с увеличением концентрации иодида. Ионы Аg+ обладают ингибиторным эффектом, блокируя катализатор. При введении в раствор ионов Аg+ происходит образованиеAgI , и концентрация I- падает, вызывая соответствующее уменьшение скорости церий-арсенитной реакции. При каталиметрическом титровании к анализируемому раствору, содержащему иодид -ион I- в церий-арсенитной смеси, несколькими порциями добавляют титрованный раствор AgNO3 и определяют скорость реакции. Точку эквивалентности находят из графика в координатах: объем раствора AgNО3 – скорость реакции, характеризуемая угловым коэффициентом dx/dt. Этим методом можно оттитровывать иодтд в очень разбавленных растворах ( 10-6 моль/л и меньше).
|
из
5.00
|
Обсуждение в статье: Метод фиксированного времени |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

