 |
Главная |
Электронные емкости орбиталей, подуровней и уровней атома
|
из
5.00
|
Ответы к зачету по химии
1.Основные понятия химии: стехиометрические коэффициенты и индексы. Моль. Молярная масса. Химический эквивалент. Фактор эквивалентности и его расчеты, молярная масса эквивалента. Закон эквивалентов.
Стехиометрические индексы - это числа, стоящие в химических формулах справа внизу при символах химических элементов. Они характеризуют количественное содержание химических элементов в соединениях. Например, индексы в формуле гидразина N2H4 показывают, что в молекуле гидразина на 2 атома азота приходится 4 атома водорода, а в 1 моль молекул гидразина на 2 моль атомов азота приходится 4 моль атомов водорода.
Стехиометрические коэффициенты – цифры перед формулами веществ, показывающие число молекул каждого из них, участвующих в химических реакциях:
3Mn.CO3 + KClO3 = 3MnO2 +KCl + 3CO2
Моль — это такое количество вещества, которое содержит число молекул (частиц, ионов, атомов), равное числу Авогадро: NA=6,02*10²³ моль ˉ¹
Молярная масса вещества (М) — масса одного моль вещества, то есть масса 6,02*10²³ молекул (по закону Авогадро), измеряется в г/моль; количество вещества, выраженное в граммах и численно равное молекулярной массе
М(HCl)=1+35,5=36,5
М(HCl)=36,5г/моль
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
H3PO4 + 2KOH → K2HPO4 + 2H2O.
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом H3PO4 будет являться условная частица 1/2H3PO4, т.к. если одна молекула H3PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы H3PO4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1.

Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
МЭ = М*fЭ (г/моль)
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
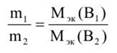
2.Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
Закон сохранения массы: Масса веществ, вступивших в реакцию, равна массе продуктов реакции. В процессе реакции сохраняется масса каждого 1 элемента. Этот закон позволяет составлять уравнения химических реакций и осуществлять расчеты на их основе. Он не является абсолютным. Абсолютным является закон сохранения энергии.
Закон сохранения энергии: Энергия не возникает из ничего и не исчезает, а только переходит из одного вида в другой. Этот закон — результат работ А. Эйнштейна. Он установил связь между энергией и массой вещества (1905 г.):
Е = тс²
где с — скорость света в вакууме, равная -300 000 км/с.
Поскольку в результате химической реакции выделяется или поглощается энергия, то, в соответствии с уравнением Эйнштейна, изменяется и масса веществ. Однако это изменение столь мало, что на практике не учитывается (так называемый дефект массы).
Закон кратных отношений: Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на определенную массу другого, относятся друг к другу как небольшие целые числа.
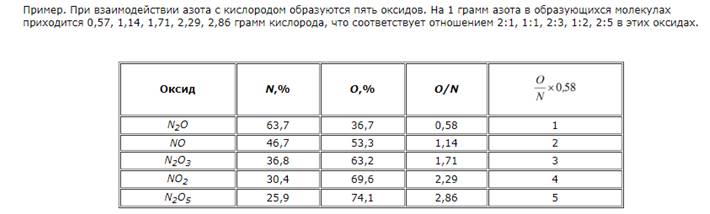
Закон постоянства состава: Соотношение между массами химических элементов, входящих в состав данного соединения, есть величина постоянная, не зависящая от способа его получения
С + О2 = СО2
СаСО3 = СаО + СО2
СаСО3 + 2НСl = СаСl2 + CО2 + Н2О
Закон Авогадро: В равных объемах различных газов при одинаковых условиях (р и Т) содержится одинаковое число молекул.
рV = nRТ
p1V1 = V1RТ1
р2V2 = V2RТ2
Закон Авогадро имеет следствия:
1. Одинаковое число молекул любого газа при одинаковых условиях занимает один и тот же объем.
2. Массы газов, взятых в одинаковых объемах при одинаковых условиях (р, Т), относятся друг к другу как их молярные массы:
т1/т2 = М1/М2
Второе следствие позволяет вывести уравнение для определения молярной массы неизвестного газа по известной величине относительной плотности этого газа по другому известному газу.
Закон простых объемных отношений: Объемы вступивших в реакцию газов относятся друг к другу и к объемам образовавшихся газов как небольшие целые числа:
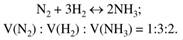
3.Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
4.Квантовые числа: главное, побочное, магнитное, спиновое.
Главное квантовое число n обозначает номер уровня.
n = 1-7 (K-Q). Целое число, характеризует энергию электронов, занимающих данный уровень.
n = 1 - Энергия минимальна
n = 7 - Энергия максимальна, электроны слабо связаны с ядром.
N = 2n2,
где N - максимальное число электронов на уровне, n - номер уровня (главное квантовое число).
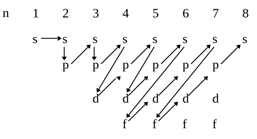
Орбитальное = побочное квантовое число l - целое от 0 до n - 1 , определяет форму орбитали.
l = 0 – s-орбиталь, шарообразная форма
l = 1 – p-орбиталь, форма объемной восьмерки («гантель»)
l = 2 – d-орбиталь, более сложная форма
l = 3 – f-орбиталь, -
Электроны с одинаковым l в пределах одного уровня образуют подуровни. Они отличаются энергией связи с ядром. Их число на уровне равно n, но не более 4.
Подуровни обозначают буквами:
s-подуровень – 1 орбиталь,
p-подуровень – 3 орбитали,
d-подуровень – 5 орбиталей,
f-подуровень – 7 орбиталей.
Элементы, у которых происходит заполнение определенного подуровня, называются соответственно s, p, d, f-элементами.
s-элементы – элементы главных подгрупп 1 и 2 групп и гелий.
p-элементы – элементы главных подгрупп 3-8 групп
d-элементы - элементы вставных декад (переходные элементы)
f-элементы – лантаноиды и актиноиды.
Магнитное квантовое число m определяет расположение орбитали в пространстве (по осям координат).
m принимает значения от –l до +l, включая 0. Число значений, принимаемых m, определяет число орбиталей на подуровне:
l = 0, m = 0 – 1 s-орбиталь
l = 1, m = -1,0,+1 - 3 p-орбитали
l = 2, m = -2,-1,0, +1,+2 – 5 d-орбиталей
l = 3, m = -3,-2,-1,0,+1,+2,+3 – 7 f-орбиталей
Спиновое квантовое число s характеризует 2 возможных направления вращения электрона вокруг своей оси: s = -½ , s = +½
↑↓ - антипараллельные спины.
5.Принципы заполнения электронных орбиталей атома: принцип Паули, правило Хунда, принцип наименьшей энергии, правило Клечковского. Электронные емкости орбиталей, подуровней и уровней атома. Способы записи электронных формул. Валентные уровни атома.
Принцип Паули: в атоме не может быть 2 электрона, у которых 4 одинаковых квантовых числа. Следовательно, на 1-ой орбитали могут находиться не более 2-х электронов, отличающихся друг от друга значением спинового квантового числа.
Правило Хунда: электроны располагаются на орбиталях равной энергии таким образом, чтобы их суммарный спин был максимальный. Это означает, что первоначально электроны заполняют все свободные орбитали данного подуровня по 1-му, имея при этом параллельные спины, и только потом происходит заполнение этих орбиталей 2-ми электронами. Количество неспаренных электронов на внешнем уровне определяет валентность элемента, т.е. способность образовывать химические связи с другими атомами. В большинстве случаев, но не всегда.
Принцип наименьшей энергии (Правило Клечковского): заполнение электронами атомных орбиталей происходит в соответствии с увеличением суммы главного и побочного квантовых чисел; если одинакова, то атомная орбиталь заполняется от больших и меньших к меньшими большим.
Электронные емкости орбиталей, подуровней и уровней атома

|
из
5.00
|
Обсуждение в статье: Электронные емкости орбиталей, подуровней и уровней атома |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

