 |
Главная |
Коллоидные растворы (золи).
|
из
5.00
|
Дисперсные системы. Коллоидные растворы.
Дисперсные системы – это системы, в которых одно вещество равномерно распределено в виде частиц внутри другого вещества.
В дисперсных системах различают дисперсную фазу (д.ф.) - мелкораздробленное вещество и дисперсионную среду (д.с.) – однородное вещество, в котором распределена дисперсная фаза.
Дисперсные системы классифицируют по степени дисперсности (раздробленности), агрегатному состоянию дисперсной фазы и дисперсионной среды, интенсивности взаимодействия между ними.
Классификация дисперсных систем по степени дисперсности и их свойства
| Грубодисперсные системы | Коллоидно-дисперсные системы (коллоидные растворы, золи) | Истинные растворы (молекулярно-ионные растворы) | |
| размер частиц больше 100 нм (1 нм =10-9 м)
| размеры частиц от 1 до 100 нм. | размер частиц менее 1 нм. | |
| Суспензии - это дисперсные системы, в которых д. ф. является твердое вещество, а д. с. жидкость, причем твердое вещество нерастворимо в жидкости (речной и морской ил, строительные растворы). | Эмульсии – это дисперсные системы, в которых и д.ф. и д.с. жидкости, которые взаимно не смешиваются (молоко, майонез) | Это высокодисперсные двухфазные системы | Ненасыщенные растворы кислот, солей, щелочей. |
| Гетерогенные | Гетерогенные | Гомогенные | |
| Термодинамически неустойчивы | Термодинамически неустойчивы | Устойчивые | |
| Частицы не проходят через бумажный фильтр | Проходят | Проходят | |
| Частицы не проходят через ультрафильтры (мембраны)
| Не проходят | Проходят | |
| Отражают свет, поэтому непрозрачны
| Прозрачные, но рассеивают свет, поэтому обладают опалесцирующим действием (дают конус Тиндаля) | Прозрачные | |
В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды различают 8 типов дисперсных систем
Классификация дисперсных систем
| Д.Ф. | Д.С. | Условное обозначение | Примеры |
| Газ Жидкость Твердое тело | Газ | Г / Г Ж / Г Т / Г | Отсутствует Туман, облака Дым, пыль, смог |
| Газ Жидкость Твердое тело | Жидкость | Г / Ж Ж1/ Ж2 Т / Ж | Пена Эмульсии Взвеси, суспензии |
| Газ Жидкость Твердое тело | Твердое тело | Г / Т Ж / Т Т1 / Т2 | Пористый шоколад, хлеб Почва, грунт Минералы, сплавы |
Коллоидные растворы (золи).
Различают лиофильные и лиофобные золи. Если дисперсионной средой является вода, их называют соответственно гидрофильными и гидрофобными. В лиофильных золях частицы д.ф. в результате взаимодействия с д.с. окружены сольватной оболочкой. К ним относятся: желатин, крахмал, кремниевая кислота.
Частицы лиофобных золей лишены сольватной оболочки, т.е. взаимодействие между д.ф. и д.с. отсутствует или выражено слабо (золи металлов, сульфидов, различных солей).
Золи обладают рядом специфических свойств, которые подробно изучает коллоидная химия.
МЕТОДЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ РАСТВОРОВ:
I. Методы диспергирования (измельчения). Диспергирование чаще всего производят при помощи особых «коллоидных мельниц» (механическое дробление), а также дроблением ультразвуком и электрическим методом.
II. Методы конденсации. Коллоидные частицы образуются за счет объединения атомов или молекул в агрегаты.
А) физические методы (метод замены растворителя)
Б) химические методы (реакции восстановления, окисления, обмена, гидролиза).
В отличие от истинных растворов для золей характерно явление Тиндаля: припропускании через золь пучка света появляется светлый конус, видимый в темном помещении в результате светорассеивания коллоидными частицами.
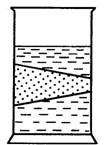
Эффект Тиндаля
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава.
Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KJ ––> AgJ + KNO3
При постепенном приливании раствора KJ в раствор AgNO3 в первый момент из ионов Ag+ и I– образуется агрегат (mAgI), в котором ионы расположены в том же порядке, что и в кристаллической решетке AgJ.
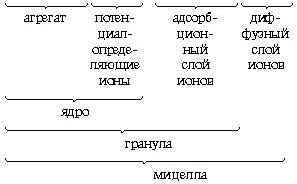
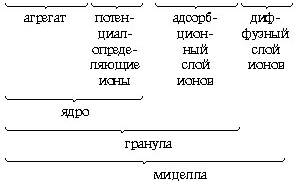
Далее агрегат (mAgI) адсорбирует на своей поверхности преимущественно те ионы, которые входят в его состав и находятся в растворе в избытке. Этим условиям в данном случае отвечают ионы серебра. Ионы, адсорбирующиеся на поверхности агрегата, придают частице заряд и называются потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристалла AgJ. Таким образом агрегаты AgJ с адсорбированными на них ионами приобретают состояние агрегативной устойчивости. Агрегат (mAgJ) вместе с потенциалопределяющими ионами Ag+ составляет ядро. К заряженному ядру притягиваются ионы противоположного заряда – противоионы. В данном случае такими ионами будут ионы, содержащиеся в растворе (но не входящие в состав агрегата), – нитрат-ионы NO3–. Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
За адсорбционным слоем противоионов следует диффузный слой тех же противоионов. Количество противоионов диффузного слоя постепенно понижается по мере удаления от ядра. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную сольватную (гидратную) оболочку.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя называется мицеллой. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы электронейтральна.
а) AgNO3 + KI ––> AgI + KNO3
изб. золь
а) 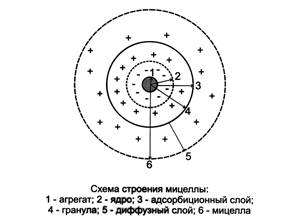
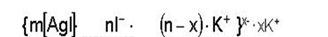
_______________________________________________________________
б) AgNO3 + KJ ––> AgJ + KNO3
изб. золь
б) 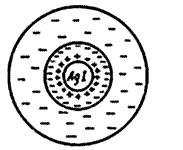
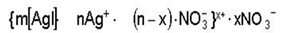
Одним из важных свойств золей является то, что их частицы имеют электрические заряды одного знака. Благодаря этому они не соединяются в более крупные частицы и не осаждаются.
Для осаждения золя необходимо, чтобы его частицы соединялись в более крупные агрегаты. Соединение частиц в более крупные агрегаты называется коагуляцией. Осаждение их под влиянием силы тяжести называют седиментацией.
Коагуляцию вызывают электролиты, другой золь, частицы которого имеют противоположный заряд, нагревание, действие света, облучение.
Чаще всего золи коагулируют прибавлением электролита. В этом случае происходит нейтрализация зарядов коллоидных частиц ионами электролита. Причем золи, содержащие положительно заряженные частицы, коагулируют под действием анионов, а золи, содержащие отрицательно заряженные частицы – под действием катионов. Чем выше заряд иона по модулю, тем больше его коагулирующая способность.
При длительном хранении гидрофильные золи могут превращаться в гель –особое студнеобразное коллоидное состояние (пищевые – зефир, мармелад, холодец; косметические – гель для душа; медицинские - мази). Есть минеральные гели – опал, жемчуг, сердолик, халцедон. При этом отдельные частицы золя связываются друг с другом, образуя сплошную пространственную сетку. Внутрь ячеек сетки попадают частицы растворителя. Дисперсная система теряет свою текучесть, приобретая новые механические свойства.
При нагревании гель может вновь превратится в золь. Для некоторых гелей характерно явление синерезиса (расслоения) – самопроизвольного выделения жидкости. При этом пространственная сетка уплотняется, ее объем уменьшается и образуется твердый коллоид.
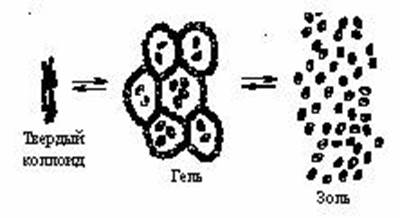
Например, в продаже имеется твердый коллоид желатина. При набухании в воде образуется гель. При нагревании образуется золь.
|
из
5.00
|
Обсуждение в статье: Коллоидные растворы (золи). |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

