 |
Главная |
О пользе питьевых минеральных вод
|
из
5.00
|
План
1. Вступление.......................................................................................................................... 3
2. Что такое вода.................................................................................................................... 9
3. Свойства воды................................................................................................................. 16
Вступление
Вода во вселенной
 Разве в космосе вода есть? Да, оказывается, вода есть в космическом пространстве. Десять лет назад астрофизики с помощью радиотелескопа обнаружили идущие к нам из космоса странные короткие радиоволны
Разве в космосе вода есть? Да, оказывается, вода есть в космическом пространстве. Десять лет назад астрофизики с помощью радиотелескопа обнаружили идущие к нам из космоса странные короткие радиоволны
— длиной 1,35 см. Оказалось, что это излучение исходит от загадочных гигантских облаков, расположенных в нашей Галактике в созвездии Ориона, Кассиопеи и в некоторых других созвездиях.
Теоретический расчет показал, что такое излучение принадлежит... воде. Молекулы водяного пара поглощают инфракрасную часть спектра света звезд и переходят в возбужденное состояние. При этом возрастает уровень энергии их вращательного движения. Когда же
молекулы снова возвращаются в основное состояние, то они начинают излучать энергию на волне 1,35 см.
И на других планетах вода есть? На этот вопрос можно дать совершенно определенный и точный ответ: да, на других планетах также есть вода.
Советские ученые послали на планету Венера автоматические химические лаборатории, которые непосредственно в атмосфере планеты произвели химический анализ ее состава и передали результаты на землю по радио.
Пролетев 500 млн км, первая из них — «Венера-4» произвела успешный спуск на парашюте в атмосфере «планеты загадок», выполнила уникальные измерения физико-химического состояния атмосферы: температуры, давления, плотности — и прямо на месте проанализировала химический состав газов. Это произошло впервые в истории науки 18 октября 1967 г. Две последующие автоматические станции достигли Венеры в мае 1969 г. И подтвердили ранее полученные результаты. Было найдено, по уточненным данным, что на Венере «воздух» содержит:
· углекислого газа — около 97%
· кислорода — не более 0,1%
· азота — не более 2%
· паров воды — около 1%
15 декабря 1970 г. межпланетная автоматическая станция «Венера-7» достигла поверхности планеты и передала на Землю сведения непосредственно с поверхности Венеры. Оказалось, что температура на планете превышает 470°С, а давление в 90 раз больше, чем на Земле.
Конечно, жидкой воды на Венере нет. Существование известных нам форм жизни на Венере невозможно. Но вода там есть, это бесспорно.
Есть предположение, что вода существует и в атмосфере Марса. В течение многих лет астрономы неоднократно наблюдали на Марсе загадочные яркие вспышки. Они послужили неплохой завязкой сюжета для многих фантастических романов. Но вот, наконец, эти таинственные вспышки были разгаданы. Наши ученые путем точного измерения углов световых лучей от этих вспышек с направлением на Солнце установили, что они вызваны отражением солнечных лучей от кристалликов льда, витающих в атмосфере Марса. Такие же явления часто наблюдаются и на Земле, когда в сильные морозы на небе появляются изображения ложных солнц. Так что очень может быть, вода есть и на Марсе. Совсем недавно это предположение получило веское подтверждение: следы водяного пара были обнаружены в атмосфере Марса спектроскопическим путем.
Астрофизики уже нашли воду и на Юпитере. Эта гигантская планета, пожалуй, с еще большим правом может быть названа планетой загадок. На роли воды в атмосфере Юпитера следует остановиться подробнее. Хотя в этом много таинственного и неразгаданного, но, может быть, именно тут наука приближается к решению величайшей тайны — тайны зарождения жизни во Вселенной.
Раскаленное, хотя и недостаточно для начала термоядерных процессов, ядро Юпитера окружено оболочкой из металлического водорода. Снаружи планета покрыта плотным слоем атмосферы толщиной в десятки тысяч километров. Внешняя температура Юпитера очень низка — около –100°С. Атмосфера его состоит главным образом из водорода и гелия. Но в ней обнаружены также метан, аммиак, сероводород и... вода.
Самые удивительные и таинственные превращения протекают в той зоне атмосферы Юпитера, где условия сходны с земными — температура лежит в пределах от 0° до 100°С и давление не превышает двух-трех атмосфер.
Астрономы обнаружили, что на Юпитере непрерывно происходят чудовищные грозы и ураганы. Там должен идти снег и дождь, как и на Земле, из воды. Но там еще льются ливни из жидкого аммиака и сероводорода, там выпадает снег из аммиака. Но и снег и ливни никогда не достигают поверхности Юпитера (быть может, ее и не существует), снова возгоняются и вновь выпадают.
Эти чудовищные условия страшного мира гигантской планеты исследователи не раз пытались воссоздать в своих лабораториях. Под действием электрических разрядов и ионизирующего излучения в модельном юпитерианском «воздухе» из паров воды, аммиака и метана возникали многочисленные органические соединения, и среди них даже аминокислоты и углеводороды.
Многие из образующихся химических соединений оказались яркоокрашенными, и их цвета по своему спектральному составу сходны с окраской облачных полос на Юпитере. Многие ученые считают, что в атмосфере Юпитера существуют условия, благоприятные для возникновения жизни.
И на Луне вода есть? Нет. Никто из людей, побывавших на Луне, пока еще воды там не нашел. Правда, однажды американский космический корабль зарегистрировал на Луне извержение загадочного «гейзера», но, что это было, пока еще не установлено.
А на кометах вода есть? Есть. Многие ученые считают, что голова кометы представляет собой твердое тело — «грязный лед», состоящий из смеси обыкновенного водяного льда и льда из застывших в космическом холоде газов аммиака, метана. В этот лед вкраплены частицы твердого метеоритного вещества, состоящего главным образом из железа, кальция, кремния и других химических элементов.
Когда комета приближается к Солнцу, более легкие молекулы испаряются, образуя величественный хвост кометы. В спектре сияния хвоста кометы и были обнаружены линии гидроксила, образующегося при распаде молекул воды.
Где еще во Вселенной может быть вода? На звездах и на нашем Солнце она вряд ли может быть. Хотя там есть и водород и кислород, но при чудовищных температурах звезд молекулы воды не могут образоваться. Но астрономы установили, что у многих звезд во Вселенной, подобно тому, как у Солнца, есть планетные системы.
Состав первичной атмосферы этих планет должен состоять из соединений водорода — наиболее обильного элемента в космосе, больше всего должно быть молекул водорода — Н2, воды — Н20, аммиака — NН3 и метана — СH4.
Вода есть во всех уголках Вселенной. Это бесспорно.
Знает ли вода, что происходит в космосе? Этот вопрос затрагивает область столь необыкновенных, столь таинственных, до сих пор совершенно непонятных наблюдений, что они вполне оправдывают образную формулировку вопроса. Экспериментальные факты как будто бы установлены твердо, но объяснения для них пока еще не найдены.
Поразительная загадка, к которой относится вопрос, была установлена не сразу. Она относится к малозаметному и как будто бы пустяковому явлению, не имеющему серьезного значения. Это явление связано с самыми тонкими и пока непонятными свойствами воды, трудно доступными количественному определению, —со скоростью химических реакций в водных растворах, и главным образом со скоростью образования и выпадения в осадок труднорастворимых продуктов реакции. Это тоже одно из бесчисленных свойств воды.
Так вот, у одной я той же реакции, проводимой в одних и тех же условиях, время появления первых следов осадка непостоянно. Хотя этот факт был давным-давно известен, химики на него внимания не обращали, удовлетворяясь, как это еще часто бывает, объяснением «случайными причинами». Но постепенно, по мере развития теории скоростей реакции и усовершенствования методики исследования, этот странный факт стал вызывать недоумение.
Несмотря на самые тщательные предосторожности в проведении опыта, в совершенно постоянных условиях результат все равно не воспроизводится: то осадок выпадает сразу, то приходится довольно долго ждать его появления.
Казалось бы, не все ли равно — выпадает осадок в пробирке за одну, две или через двадцать секунд? Какое это может иметь значение? Но в науке, как и в природе, нет ничего не имеющего значения.
Странная невоспроизводимость все более и более занимала ученых. И, наконец, был организован и осуществлен совершенно небывалый эксперимент. Сотни добровольных исследователей-химиков во всех частях земного шара по единой, заранее разработанной программе, одновременно, в один и тот же момент по мировому времени снова и снова повторяли один и тот же простой опыт: определяли скорость появления первых следов осадка твердой фазы, образующейся в результате реакции в водном растворе. Опыт продолжался почти пятнадцать лет, было проведено более трехсот тысяч повторений.
Постепенно стала вырисовываться удивительная картина, необъяснимая и загадочная. Оказалось, что свойства воды, определяющие протекание в водной среде химической реакции, зависят от времени.
Сегодня реакция протекает совсем иначе, чем в тот же момент она шла вчера, и завтра она будет идти снова по-другому.
Различия были невелики, но они существовали и требовали внимания, исследования и научного объяснения.
Результаты статистической обработки материалов этих наблюдений привели ученых к поразительному выводу: оказалось, что зависимость скорости реакции от времени для разных частей земного шара совершенно одинаковая.
Это означает, что существуют какие-то таинственные условия, изменяющиеся одновременно на всей нашей планете и влияющие на свойства воды.
Дальнейшая обработка материалов привела ученых к еще более неожиданному выводу. Оказалось, что события, протекающие на Солнце, каким-то образом отражаются на воде. Характер реакции в воде следует ритму солнечной активности — появления пятен и вспышек на Солнце.
Но и этого мало. Обнаружено еще более невероятное явление. Вода каким-то необъяснимым путем отзывается на то, что происходит в космосе.
Была установлена четкая зависимость от изменения относительной скорости Земли в ее движении в космическом пространстве.
Таинственная связь воды и событий, происходящих во Вселенной, пока необъяснима.
А какое значение может иметь связь между водой и космосом? Никто еще не может знать, насколько оно велико… В нашем теле около 75% воды; на нашей планете нет жизни без воды; в каждом живом организме, в каждой его клеточке протекают бесчисленные химические реакции. Если на примере простой и грубой реакции подмечено влияние событий в космосе, то пока даже и представить себе нельзя, как велико может быть значение этого влияния на глобальные процессы развития жизни на Земле. Наверное, станет очень важной и интересной наука будущего — космобиология. Одним из ее главных разделов явится изучение поведения и свойств воды в живом организме.
Вода и здоровье
 На воду приходится 55 - 70% веса тела взрослого человека. В мышцах содержится больше воды, чем в жире, поэтому чем вы стройнее, тем больше доля воды в вашем теле. Вода содержится в каждой клетке организма. Кровь состоит из воды на 83%, мышцы - на 73%, жиры - на 25%, кости - на 22%.
На воду приходится 55 - 70% веса тела взрослого человека. В мышцах содержится больше воды, чем в жире, поэтому чем вы стройнее, тем больше доля воды в вашем теле. Вода содержится в каждой клетке организма. Кровь состоит из воды на 83%, мышцы - на 73%, жиры - на 25%, кости - на 22%.
Достаточное поступление воды в организм является одним из основных условий здорового образа жизни. Вода активно участвует в химических реакциях проходящих в нашем организме, доставляет питательные вещества в каждую клетку тела, выводит из организма токсины, шлаки и излишки солей, содействует понижению кровяного давления, уменьшая тем самым вероятность сердечного приступа. Потребление достаточного количества воды - это один из лучших способов предотвратить образование камней в почках. Вода смазывает суставы, выполняет роль амортизатора для спинного мозга, через дыхательную систему регулирует температуру тела, благотворно влияет на состояние кожи.
Участвуя в обмене веществ, вода позволяет уменьшить жировые накопления и снизить вес. Многие из тех, кто хочет похудеть, считают, что их организм удерживает воду и стараются меньше ее пить. Однако вода является естественным мочегонным средством и, если вы ее пьете, то теряете в весе.
Если организм получает достаточное количество воды, то человек становится более энергичным и выносливым. Ему проще контролировать свой вес, поскольку улучшается пищеварение, а когда вас тянет перекусить, часто достаточно бывает просто попить воды, чтобы снизить аппетит. Симптомами обезвоживания организма являются сухая кожа (может сопровождаться зудом), усталость, плохая концентрация внимания, головные боли, запоры, повышение давления, плохая работа почек, повторяющаяся инфекция мочеполовых путей, сухой кашель, боли в спине и суставах.
О пользе питьевых минеральных вод
 Поскольку минеральные питьевые поды оказывают на организм выраженное воздействие и при неправильном приеме могут вызвать различные тяжелые нарушения электролитного состава, они назначаются только врачом. В домашних условиях продолжительность курса питьевого лечения минеральной водой составляет от 3 до 6 недель. Повторные курсы лечения проводят обычно через 3-5 месяцев, но не чаще двух раз в год. Следует помнить, что минеральные питьевые воды показаны далеко не всем желающим. Они противопоказаны при обострениях хронических заболеваний желудочно-кишечного тракта с рвотой, поносом, кровотечением и резким болевым синдромом, желчнокаменной болезни, остром холецистите, сужении пищевода и привратника, недостаточности кровообращения и острой задержке мочи. Эффективность внутреннего применения минеральных вод тем выше, чем более правильно подобран класс минеральных вод и чем строже соблюдаются пациентами предписанные врачом методики лечения. Наряду с питьевым лечением минеральные воды применяют также и в других лечебных методиках в домашних условиях.
Поскольку минеральные питьевые поды оказывают на организм выраженное воздействие и при неправильном приеме могут вызвать различные тяжелые нарушения электролитного состава, они назначаются только врачом. В домашних условиях продолжительность курса питьевого лечения минеральной водой составляет от 3 до 6 недель. Повторные курсы лечения проводят обычно через 3-5 месяцев, но не чаще двух раз в год. Следует помнить, что минеральные питьевые воды показаны далеко не всем желающим. Они противопоказаны при обострениях хронических заболеваний желудочно-кишечного тракта с рвотой, поносом, кровотечением и резким болевым синдромом, желчнокаменной болезни, остром холецистите, сужении пищевода и привратника, недостаточности кровообращения и острой задержке мочи. Эффективность внутреннего применения минеральных вод тем выше, чем более правильно подобран класс минеральных вод и чем строже соблюдаются пациентами предписанные врачом методики лечения. Наряду с питьевым лечением минеральные воды применяют также и в других лечебных методиках в домашних условиях.
Гидрокарбонатно-сульфидно-хлоридные лечебно-столовые воды используют в виде ингаляций при заболеваниях верхних дыхательных путей и легких. Лучше всего для ингаляций применять минеральные воды "Боржоми", "Варзн Ятчи", "Ессентуки 4", "Ноябрьская" и "Смирновская". Мелкораспыленный аэрозоль минеральной воды температуры 35-40 °С больные вдыхают в течение 6-12 мин. ежедневно в течение 7-10 дней. Гидрокарбонатно-хлоридные лечебно-столовые минеральные воды применяют для полосканий рта и глотки при заболеваниях полости рта, пародонта и глотки. С этой цель больные набирают в рот одну из следующих минеральных вод - "Азовскую", "Боржоми", "Ессентуки 4 и 17" "Нарзан", "Екатерингофская", "Семигорская» и другие. Минеральную воду температуры 33-42 °С набирают в рот и держат ее в течение 2-3 мин. Полоскания проводят от 1-го до 15 дней ежедневно.
Кроме полосканий и ингаляций сульфатные минеральные питьевые воды применяют также для стимуляции выделения желчи (беззондовый дренаж - тюбаж), а также для очистительных клизм при хронических заболеваниях толстого кишечника. Итак, многообразие минеральных питьевых вод на торговых прилавках безусловно радует глаз покупателя. Однако, выбирая воду для употребления, они должны придерживаться определенных рекомендаций, часть из которых изложена выше. Более подробную информацию и совет можно получить у своего лечащего врача. Выбор столовых минеральных вод от них свободен и зависит от вкусов и желаний покупателя. Следует твердо помнить - минеральные питьевые воды - неисчерпаемый родник аппетита, бодрости и здоровья в вашем доме
Что такое вода
 Что такое вода? Такой вопрос может показаться не только странным, но и немного невежливым. Кто же этого может не знать? Всякий знает, что вода — это соединение водорода и кислорода. Вот ее всем известная формула: Н2О.
Что такое вода? Такой вопрос может показаться не только странным, но и немного невежливым. Кто же этого может не знать? Всякий знает, что вода — это соединение водорода и кислорода. Вот ее всем известная формула: Н2О.
С водой очень хорошо знаком каждый, кто привык умываться по утрам, пьет чай, умеет плавать, любит бегать под дождем, не боясь промокнуть, кататься на коньках и ходить на лыжах.
А что такое водород? Вообще говоря, подобные вопросы задавать не следует. На них просто нельзя ответить из-за неисчерпаемости содержания. Всю жизнь можно отдать изучению водорода и до конца ответа не получить.
Но все-таки кое-что сказать следует. Химики до сих пор никак не могут решить, где же должен стоять водород в таблице Менделеева, и помещают его одновременно сразу в двух группах: в VII, где он зачисляется в родственники галогенам — фтору, хлору, брому, и в I группу за его сходство со щелочными металлами — литием, натрием, калием. Так что же такое водород?
В свое время наши исследователи, изучая свойства водорода при высоких давлениях, обнаружили, что при давлении около трех миллионов атмосфер сжатый водород внезапно приобретает удивительное свойство — он становится электропроводным, так же как любые обычные металлы. Это явление теоретики предвидели уже давно, а теперь оно было обнаружено на опыте. Как ни удивительно, но, по-видимому, водород — металл.
Сколько существует различных водородов? В природе существует три различных водорода — три его изотопа. Самый легкий — 1H. Химики его часто называют протием. Водород в обычной воде почти нацело состоит из протия. Кроме него, во всякой воде есть тяжелый водород — дейтерий 2Н, его чаще в химии обозначают символом D. Дейтерия в воде очень мало. На каждые 6700 атомов протия в среднем приходится только один атом дейтерия. Кроме протия и дейтерия, существует еще сверх тяжелый водород 3Н. Его обычно называют тритием и обозначают символом Т.
Тритий радиоактивен, период его полураспада немного больше 12 лет. Он непрерывно образуется в стратосфере под действием космического излучения. Количество трития на нашей Земле исчезающе мало — меньше одного килограмма на всем земном шаре; но, несмотря на это, его можно обнаружить повсюду, в любой капле воды.
Физики научились получать тритий искусственно в ядерных реакторах.
Ученые заподозрили, что возможно существование четвертого изотопа водорода — 4Н и даже пятого — 5Н. Они тоже должны быть радиоактивными.
А больше нет никаких водородов? Да, как будто бы больше нет. По крайней мере, ученые пока новых водородов еще не нашли. Но зато известны антипротон и позитрон. Значит, можно говорить об антиводороде, в атомах которого вокруг отрицательного ядра (антипротона) вращается положительный электрон (позитрон). Найден также и антидейтрон, следовательно, возможно, что существует и антиизотоп водорода с массовым числом 2 — антидейтерий. Недавно найдено ядро антитрития.
Не может быть никакого сомнения в том, что из этих антиядер и позитронов могут образоваться антиатомы, но пока даже самых простых антиатомов антиводорода никто еще не наблюдал.
Сколько на свете кислородов? В природе найдены три различных изотопа кислорода. Больше всего легкого кислорода 16О, значительно меньше тяжелого 18О и совсем мало кислорода 17О. В кислороде воздуха, которым мы дышим, на каждые 10 атомов 17О приходится 55 атомов 18О и более 26 000 атомов изотопа кислорода 16О.
Физики сумели создать в своих ускорителях и реакторах еще пять радиоактивных изотопов кислорода: 13О, 14О, 15О, 19О, 20О. Все они живут очень недолго и через несколько минут распадаются, превращаясь в изотопы других элементов.
Сколько может быть различных вод? Если подсчитать все возможные различные соединения с общей формулой Н2О, то результат покажется  неожиданным: всего могут существовать сорок восемь разных вод. Из них тридцать девять вод будут радиоактивными, но и стабильных, устойчивых вод тоже будет немало — девять:
неожиданным: всего могут существовать сорок восемь разных вод. Из них тридцать девять вод будут радиоактивными, но и стабильных, устойчивых вод тоже будет немало — девять:
Н216O, Н217O, Н218O, HD16O, HD17O, HD18O, D216O, D217O, D218O.
Если же окончательно подтвердится сообщение о том, что существуют еще два сверхтяжелых изотопа водорода — 4Н и 5Н, то будут возможны уже сто двадцать различных вод. Но и это еще не все. Советские физики в 1970 г. на большом ускорителе многозарядных ионов создали совершенно удивительный кислород — сверхтяжелый изотоп 24О. В его ядре огромный избыток нейтронов, и оно очень неустойчиво. Если принять во внимание и этот новый изотоп кислорода, то тогда различных вод можно будет насчитать уже сто тридцать пять!
Подсчитайте сами, сколько различных вод, молекулы которых содержат тритий, может образовываться на границе с космосом и постепенно вместе с дождями выпадать на землю. Попробуйте сосчитать также, сколько различных радиоактивных вод возникает в воде, охлаждающей атомный реактор. Где бы в мире ни зачерпнуть стакан воды, в нем всегда окажется смесь различных молекул, неодинаковых по изотопному составу. Конечно, вероятность образования молекул с разным изотопным составом далеко не одинакова. Молекулы, содержащие сразу два или три редко встречающихся изотопных атома, будут возникать так редко и их будет так мало, что, по мнению физиков, их пока можно не принимать во внимание.
Что же такое обыкновенная вода? Такой воды в мире нет. Нигде нет обыкновенной воды. Она всегда необыкновенная. Даже по изотопному составу вода в природе всегда различна. Состав зависит от истории воды — от того, что с ней происходило в бесконечном многообразии ее круговорота в природе. При испарении вода обогащается протием, и вода дождя, поэтому отлична от воды озера. Вода реки не похожа на морскую воду. В закрытых озерах вода содержит больше дейтерия, чем вода горных ручьев. В каждом источнике свой изотопный состав воды.
Когда зимой замерзает вода в озере, никто из тех, кто катается на коньках, и не подозревает, что изотопный состав льда изменился: в нем уменьшилось содержание тяжелого водорода, но повысилось количество тяжелого кислорода. Вода из тающего льда другая и отличается от воды, из которой лед был получен.
Если воду разложить химически и сжечь добытый из нее водород, то получится снова вода, но совсем другая, потому что в воздухе изотопный состав кислорода отличается от среднего изотопного состава кислорода воды. Но зато в отличие от воды изотопный состав воздуха один и тот же на всем земном шаре.
Вода в природе не имеет постоянного изотопного состава, она вечно меняется, и только поэтому нельзя сказать, что где-то есть какая-то обыкновенная вода.
Что такое легкая вода? Это та самая вода, формулу которой знают все школьники — 1Н216О. Но такой воды в природе нет. Такую воду с огромным трудом приготовили ученые. Она им понадобилась для точного измерения свойств воды, и в первую очередь для измерения ее плотности. Пока такая вода существует только в нескольких крупнейших лабораториях мира, где изучают свойства различных изотопных соединений.
Что такое тяжелая вода? И этой воды в природе нет. Строго говоря, нужно было бы называть тяжелой воду, состоящую только из одних тяжелых изотопов водорода и кислорода — D218O; но такой воды нет даже и в лабораториях ученых. Конечно, если эта вода понадобится науке или технике, ученые сумеют найти способ, как ее получить: и дейтерия, и тяжелого кислорода в природной воде сколько угодно.
В науке и ядерной технике принято условно называть тяжелой водой тяжеловодородную воду. Она содержит только дейтерий, в ней совсем нет обычного легкого изотопа водорода. Изотопный состав по кислороду в этой воде соответствует обычно составу кислорода воздуха. Формулу тяжеловодородной воды написать нельзя. Это не химическое соединение, а смесь нескольких различных вод, в которых во всех содержится дейтерий, легкого водорода нет совсем, а стабильные изотопы кислорода в этой смеси вод с разным изотопным составом находятся точно в таком же соотношении, в каком они присутствуют в воздухе.
Еще совсем недавно никто в мире и не подозревал, что такая вода существует, а теперь во многих странах мира работают гигантские заводы, перерабатывающие миллионы тонн воды, чтобы извлечь из нее дейтерий и получить чистую тяжелую воду.
Бывает ли полутяжелая вода? Полутяжелой водой можно назвать воду со смешанными молекулами состава HDO. Она есть во всякой природной воде, но получить ее в чистом виде невозможно, потому что в воде всегда протекают реакции изотопного обмена. Атомы изотопов водорода очень подвижны и непрерывно переходят, из одной молекулы воды в другую. Приготовить воду, средний состав которой будет соответствовать формуле полутяжелой воды, нетрудно. Но благодаря реакции обмена: обой смесь молекул с разным изотопным составом: Н2О, HDO, D2O.
Что такое нулевая вода? Нулевая вода состоит из чистого легкого водорода и кислорода воздуха. И для нулевой воды формулу не напишешь. Она тоже смесь нескольких вод, каждая из которых состоит из легкого водорода и одного из стабильных изотопов кислорода.
Соотношение между кислородами в нулевой воде тоже точно такое же, как в воздухе. Тяжелого водорода в нулевой воде нет.
Эту воду физико-химики выбрали в качестве эталона: у нее очень постоянный состав. Ее не так уж трудно получать, и с ней удобно сравнивать воду неизвестного состава: определив разницу в плотности, легко найти содержание дейтерия.
А может быть, есть еще какая-нибудь вода? Кроме всех перечисленных вод, еще существует тяжелокислородная вода — Н218О. Получить ее из природной воды очень сложно и трудно. До сих пор эту воду в чистом виде еще, пожалуй, никто не сумел приготовить.Тяжелокислородная вода очень нужна для исследования многих биологических и химических процессов, поэтому довольно концентрированные растворы этой воды в воде обычной получают теперь на заводах.
А радиоактивная вода существует? Да. Физики научились получать тритиевую воду искусственным путем в атомных реакторах. Из-за сильной радиоактивности эта вода очень опасна. Пока такая вода нужна только ученым.
Больше еще никаких вод не получено? Больше нет. Просто потому, что все остальные возможные воды пока еще никому не нужны. Если понадобятся и они, то, без сомнения, наука найдет способ получать любую из них.
Должна ли существовать антивода? К сожалению, физики на этот вопрос пока ответить не могут. Хотя и есть все основания утверждать возможность существования антиводорода, но говорить об антикислороде еще рано. Наши исследователи, правда, уже получили ядра одного из изотопов антигелия — антигелий-3. Если уже получен антиэлемент № 2, то можно высказать надежду, что физики скоро могут дойти и до антиэлемента № 8 (антикислорода), скорее всего, они приготовят его сами. Тогда можно будет говорить и об антиводе. Вода же из антиводорода и обычного кислорода, как вы сами понимаете, немыслима. Их встреча может только привести к большой катастрофе.
Поэтому не следует пока подсчитывать число различных вод, содержащих изотопы антиводорода. Для того чтобы могла возникнуть молекула антиводы, должен существовать и антикислород. Пока мы еще о нем ничего не знаем. Но может быть, где-нибудь в недрах Вселенной есть миры (физики и астрономы обсуждают этот вопрос совершенно серьезно), состоящие из антивещества. В этих антимирах и существует, может быть, столько же различных антивод, сколько мы их насчитали в нашем мире. Так это или нет, никто еще сказать не может. Поэтому, сколько всего в мире может существовать различных вод, мы еще не знаем.
Много ли различных вод содержится в воде? В какой воде? В той, что льется из водопроводного крана, куда она пришла из реки, тяжелой воды D216O около 150 г на тонну, а тяжелокислородной (Н217О и Н218О вместе) почти 1800 г на тонну воды. А в воде из Тихого океана тяжелой воды почти 165 г на тонну.
В тонне льда одного из больших ледников Кавказа тяжелой воды на 7 г больше, чем в речной воде, а тяжелокислородной воды столько же. Но зато в воде ручейков, бегущих по этому леднику, D216O оказалось меньше на 7 г, а Н218О — на 23 г больше, чем в речной.
Тритиевая вода Т216О выпадает на землю вместе с осадками, но ее очень мало — всего лишь 1 г на миллион миллионов тонн дождевой воды.
В океанской воде ее еще меньше.
Строго говоря, вода всегда и всюду разная. Даже в снеге, выпадающем в разные дни, разный изотопный состав. Конечно, отличие невелико. Всего 1—2 г на тонну. Только, пожалуй, очень трудно сказать — мало это или много.
 Тяжёлая вода потому и тяжёлая, что тяжелее обычной. Её плотность 1,104.
Тяжёлая вода потому и тяжёлая, что тяжелее обычной. Её плотность 1,104.
Тяжёлая вода замерзает при более высокой температуре, чем обычная вода (3,813°C)…
…и кипит при более высокой температуре (101,431°C).
В чем же различие между легкой природной и тяжелой водой? Ответ на этот вопрос будет зависеть от того, кому он задан. Каждый из нас не сомневается, что с водой-то он знаком хорошо. Если каждому из нас показать три стакана с обычной, тяжелой и легкой водой, то каждый даст совершенно четкий и определенный ответ: во всех трех сосудах простая чистая вода. Она одинаково прозрачна и бесцветна. Ни на вкус, ни на запах нельзя найти между ними никакой разницы. И это будет верно. Это все — вода.
Химик на этот вопрос ответит почти так же, между ними нет почти никакой разницы. Все их химические свойства почти неразличимы: в каждой из этих вод натрий будет одинаково выделять водород, каждая из них при электролизе будет одинаково разлагаться, все их химические свойства будут почти совпадать. Это и понятно: ведь химический состав у них одинаков. Это вода.
Физик не согласится. Он укажет на заметную разницу в их физических свойствах; и кипят и замерзают они при различных температурах, плотность у них разная, а упругость их пара тоже немного различна. И при электролизе они разлагаются с разной скоростью. Легкая вода чуть быстрее, а тяжелая — помедленнее. Разница в скоростях ничтожна, но остаток воды в электролизере оказывается немного обогащенным тяжелой водой. Таким путем она и была открыта. Изменения в изотопном составе мало влияют на физические свойства вещества. Те из них, которые зависят от массы молекул, изменяются заметнее, например скорости диффузии молекул пара.
Биолог, пожалуй, станет в тупик и не сразу сумеет найти ответ. Ему нужно будет еще немало поработать над вопросом о различии между водой с разным изотопным составом. Совсем недавно все считали, что в тяжелой воде живые существа не могут жить.
Ее даже мертвой водой называли. Но оказалось, что если очень медленно, осторожно и постепенно заменять протий в воде, где живут не которые микроорганизмы, на дейтерий, то можно их приучить к тяжелой воде и они будут в ней неплохо жить и развиваться, а обычная вода для них станет вредной.
Кому же нужна тяжелая вода? Человечеству? Оно уже стоит у порога, за которым ждет его страшная угрозаэнергетического голода. И вся надежда связана с тем, что будет решена проблема, как использовать для энергетики тяжелую воду.
Зачем нужна тяжелая вода теперь? Все, что мы до сих пор говорили, касалось тех свойств, которые зависят от строения атомов, от их порядкового номера, от числа и расположения электрических зарядов в атомных ядрах и электронов в молекуле. Только это и определяет химическое поведение вещества. Строение молекулы не зависит от массы атомного ядра. Поэтому одинаковые молекулы с разным изотопным составом химически почти неразличимы.
Правда, в науке слово «почти» нужно употреблять очень осторожно и осмотрительно. Это верно, что химические соединения, различные по изотопному составу, по химическим свойствам почти неразличимы. Но все же они ведут себя немного по-разному, хотя наблюдаемые при этом изотопные эффекты очень невелики: чуть-чуть различаются по скорости реакций, у них чуть-чуть различны значения константы равновесия. Различаются между собой спектры одинаковых по составу и строению молекул с разным изотопным составом.
Сходство в свойствах изотопных соединений прекращается, когда вопрос касается кинетических и ядерных характеристик. Молекула, содержащая тяжелый изотопный атом, при той же температуре движется с меньшей скоростью, при столкновении таких частиц иначе протекает обмен кинетической энергией. А самое главное — изменяется способность вступать в ядерные превращения. Вот эти-то свойства резко отличают тяжелую воду от любой другой воды с иным изотопным составом: ведь в ее состав входит тяжелый водород. В наши дни тяжелая вода успешно применяется в атомной энергетике для замедления нейтронов в ядерных реакторах.
Роль замедлителя в атомном котле очень важна. Когда ядро урана-235 распадается на два атомных ядра-осколка, из него одновременно вылетают два или три нейтрона. Скорость их огромна, она превышает 20 000 км/с. Эти быстрые нейтроны не могут сами вызвать новый распад в других атомах урана. Они пролетят мимо них с такой быстротой, что просто не успеют прореагировать.
Нейтроны нужно замедлить примерно до 2,2 км/с, так чтобы они пришли в равновесие с тепловым движением окружающих молекул. При этом энергия нейтронов должна уменьшиться почти в 60 млн. раз. Далеко не всякое вещество пригодно в качестве замедлителя. Выбор очень ограничен. Во-первых, оно не должно поглощать нейтроны, вступая само в ядерные реакции, а во-вторых, оно должно состоять обязательно из легких элементов с малыми массовыми числами. При соударении с тяжелым ядром скорость нейтрона почти не изменяется, точно так же как почти не изменяется скорость мяча, отскакивающего при ударе о стенку.
Самым лучшим замедлителем мог бы быть легкий водород, но он заметно поглощает нейтроны. Тяжелый водород их почти не поглощает. Нейтрону, попавшему в тяжелую воду, достаточно всего 25 раз столкнуться с тяжелым водородом, чтобы потерять свою высокую энергию и приобрести способность взаимодействовать с ураном. Неплохой замедлитель — углерод в форме графита, но нейтрону в нем приходится испытывать около 110 столкновений, чтобы утратить начальную скорость.
Используя тяжелую воду как замедлитель, конструкторы создают очень эффективные, а главное, легкие и компактные атомные энергетические установки, применяемые в основном на транспорте.
Зачем еще нужна тяжелая вода? Чтобы исследовать механизм многих химических, физических и биологических процессов.
Это, конечно, скромное, но очень важное применение тяжелой воды. Наверное, нет ни одного природного процесса, в котором не принимали бы участия вода или водород. Атомы тяжелого водорода — наиболее важные меченые атомы. Их, как разведчиков в бой, направляют химики в исследуемые реакции, чтобы проследить за ее ходом. В наши дни уже возникла и быстро развивается самостоятельная область науки — химия изотопного обмена. Наиболее важная ее задача — изучать с помощью дейтерия механизм химических реакций при получении органических соединений и исследовать их строение.
Почему же человечеству будет нужна именно тяжелая вода? Чтобы ответить на этот вопрос, нельзя обойтись без самого замечательного языка, без языка цифр и формул. Он понятен всем по-настоящему грамотным людям, в какой бы стране они ни жили и на каком бы языке ни разговаривали.
Для химиков теперь очень точно измерены массы всех изотопных атомов. Вот некоторые значения этих масс:
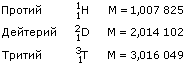
Физики сумели установить возможность ядерных реакций между легкими атомами, в том числе возможность реакции между атомами дейтерия:
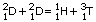
В такой реакции неприменим закон сохранения массы, каким пользуется обычная химия; в результате реакции получается недостача:
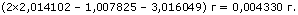
Это немалая недостача. Она означает, что если бы удалось найти условия, при которых может протекать реакция между двумя молями тяжелого водорода, то, согласно уравн<
|
из
5.00
|
Обсуждение в статье: О пользе питьевых минеральных вод |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

