 |
Главная |
Определение сорбционной способности и коэффициентов распределения ионов при различной кислотности
|
из
5.00
|
Коэффициенты распределения являются основной характеристикой равновесия в методах разделения и концентрирования. Зная значения коэффициентов распределения, можно моделировать условия сорбции компонентов, а также условия их разделения.
Коэффициенты распределения выражаются через аналитические концентрации компонентов, поэтому зависят от всех параметров среды (Т, Y, pH, pL). Наибольший практический интерес представляет зависимость Dc от кислотности среды.
Коэффициенты распределения определяют путем встряхивания точной навески воздушно-сухого ионита с определенным количеством исследуемого раствора до достижения равновесия. После достижения равновесия в растворе определяют количество непоглощенных смолой ионов и рассчитывают значение коэффициентов распределения в данных условиях:
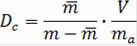
m - масса элемента в первоначальном объеме, г;
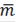
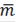 - масса элемента в фазе ионита, г;
- масса элемента в фазе ионита, г;
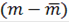
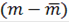 - масса элемента в растворе после достижения равновесия;- объем стандартного раствора, мл;- масса смолы, г.
- масса элемента в растворе после достижения равновесия;- объем стандартного раствора, мл;- масса смолы, г.
Нами были определены коэффициенты распределения Zn на КУ-2, Ц и ЦХ.
Методика
Реактивы:
Цинк хлористый, раствор, содержащий 1 мг/мл цинка;
Соляная кислота, 1 н раствор;
Комплексон III, 1 н раствор;
Катионит КУ-2 в Н-форме;
Аммиачная буферная смесь;
Индикатор - эриохром черный Т.
Определение коэффициентов распределения цинка
В склянки на 100 мл помещают 20 мл стандартного раствора цинка и 20 мл соляной кислоты соответствующей концентрации: 0,05 н; 0,1 н; 0,2 н; 0,5 н; 1,0 н. В склянки вносят по ~ 0,50 г воздушно-сухого катионита КУ-2 в Н-форме. Склянки оставляют на 7 дней до достижения равновесия или ставят на механический встряхиватель на 3 часа. После установления равновесия раствор отфильтровывают в мерную колбу на 50 мл, в аликвотной части раствора (10 мл) определяют содержание цинка комплексонометрическим методом в среде аммонийной буферной смеси, индикатор - эриохром черный Т.
Данные эксперимента приведены в таблице 3:
| КУ-2 | ||||||
| № | Сн(HCl), моль/л | VТ, мл | m(Zn)исх, г | m(Zn) p-p, г | mпогл, г | Dc |
| 1 | 0,9475 | 11,3 | 19,6 | 14,8 | 4,8 | 0,026 |
| 2 | 0,4765 | 6,9 | 19,6 | 9,07 | 10,53 | 0,091 |
| 3 | 0,2 | 1,75 | 19,6 | 2,3 | 17,3 | 0,6 |
| 4 | 0,1 | 0,9 | 19,6 | 1,2 | 18,4 | 1,23 |
| 5 | 0,05 | 0,65 | 19,6 | 0,85 | 18,75 | 1,8 |
| 6 | - | 0,1 | 19,6 | 0,13 | 19,47 | 12 |
| Ц | ||||||
| 1 | 0,9475 | 6,45 | 19,6 | 8,47 | 11,13 | 0,105 |
| 2 | 0,2 | 3,775 | 19,6 | 4,96 | 14,64 | 0,246 |
| 3 | 0,05 | 1,6 | 19,6 | 2,1 | 17,5 | 0,667 |
| 4 | - | 0,6 | 19,6 | 0,79 | 18,81 | 1,905 |
При титровании Zn в растворе после сорбции на ЦХ-образце получились неожиданные результаты: масса Zn в растворе после сорбции оказалась больше первоначальной. Этот результат требует дальнейшего исследования.
| ЦХ | ||||||
| 1 | 0,9475 | 28,85 | 19,6 | 37,91 | - | - |
| 2 | 0,2 | 23,3 | 19,6 | 30,62 | - | - |
| 3 | 0,05 | 24,6 | 19,6 | 32,32 | - | - |
| 4 | - | 19,65 | 19,6 | 25,82 | - | - |
На рисунке 2 показаны зависимости коэффициента распределения КУ-2 и Ц от рН:
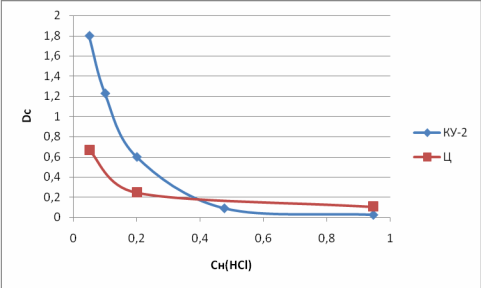
Рис. 2
При ионном обмене: nR-H + Mn+ → Rn-M + nH+ вытесняются протоны и поэтому увеличение кислотности должно смещать равновесие ионного обмена и уменьшать значение Dc.
Полученные экспериментальные данные подтверждают данную закономерность, Наибольшие значения Dc достигаются при сорбции из нейтральных сред.
Из приведенных выше данных следует, что коэффициенты распределения Zn для КУ-2 выше, чем для Ц. Следовательно Ц, не переведенный в Н-форму не может конкурировать с КУ-2 в качестве ионообменника.
Выводы
Методом потенциометрического титрования изучены кислотно-основные свойства клиноптилолита и его формы, модифицированной хитозаном. Показано, что переведение клиноптилолита, модифицированного хитозаном, в Н-форму улучшает его ионообменные свойства.
Определены значения статической обменной емкости клиноптилолита и его формы, модифицированной хитозаном, методами прямого и обратного титрования. Установленно, что модификация цеолита хитозаном уменьшает Ес - примерно в 2 раза.
Проведено определение коэффициентов распределения Zn на клиноптилолите и его форме, модифицированной хитозаном. Показано, что цеолит не имеет высоких значений Dc для этого металла по сравнению с ионообменником КУ-2.
Список литературы
1. Брек Д. Цеолитовые молекулярные сита / Д. Брек - М., 1976 - 781 с.
2. Ферсман А.Е. Материалы к исследованию цеолитов России. Избранные труды. В 2-х кн. Часть 1 / А.Е. Ферсман - М.: АН СССР, 1952 - С. 863.
3. Вернадский В.И. Земные силикаты, алюмосиликаты и их аналоги / В.И. Вернадский, С.М. Курбатов - Л.- М.: ОНТИ СССР НКТП, 1937 - 378 с.
4. Ануров С.А. Труды МХТИ им. Д.М. Менделеева / С.А. Ануров, Н.В. Кельцев, Н.С. Тороченшиков // 1974. № 79. С. 3, 4.
5. Ануров С.А. Труды МХТИ им. Д.М. Менделеева. / С.А. Ануров, И.А. Белицкий, И.Д. Кравцова // 1974. № 79. С. 5 - 7.
6. Челищев Н.Ф. Клиноптилолит / Н.Ф. Челищев, В.Г. Беренштейн - М.: ВИЭМС, 1974. 40 с.
7. Соколов В.А. Молекулярные сита и их. применение. / В.А. Соколов, Н.В. Кельцев, Н.С. Тороченшиков - М.: Химия, 1964. 156 с.
8. Grabner О.O. Grabner, P. Lira, M. Ralek - Berlin: VEB Deutscher Verlag der Wisseaschaften, 1968 - 176 p.
9. Мак-Бэн Д. Сорбция газов и паров твердыми телами / Д. Мак-Бэн М. - Л: Госхимиздат, 1934.
10. Bragg L. Crystal Structure of Minerals / L. Bragg, G.F. Claringbull // Ithaca: Cornell Univ. Press. 1965. №. 4.
11. Полинг Л. Природа химической связи / Л. Полинг - М.- Л.: Госхимиздат. 1947.
12. Rorrer G.L. Way ID / G.L. Rorrer, T.Y. Hsien // Industr. Engin. Chem. Research. 1993.V. 32, №9. P. 2170-2178.
13. H.П. Шапкин, А.Г. Боровик и др. Рациональное использование цеолитов для извлечения белка из отходов рыбоперерабатывающей промышленности. Тезисы докладов Международно-практическая конференция «Экология и безопасность жизнедеятельности». Владивосток 1994. С 21-23.
14. Н.П. Шапкин, А.С. Скобун и др. Получение модифицированных сорбентов на основе цеолитов Дальнего Востока. Тезисы докладов Международного симпозиума «Первые чтения. Причины и процессы создания неорганических материалов». Хабаровск 1998. С. 169.
15. Lukac P.P. Lukac, P. Hjozek, M. Foldesova // J. Radional. and Nucl. Chem. Lett. 1992. V. 164, №4. P. 241-246.
16. Hlozek P.P. Hlozek, M. Foldesova, P. Lukac // J. Radional. and Nucl. Chem. Lett. 1992. V. 165. №3. P. 175-183.
17. Dyer A.A. Dyer, L. Jozefowicz // J. Radional. and Nucl. Chem. Lett. 1992 V. 159. № 4. P. 47-62.
18. Zentgraf B.B. Zentgraf, C. Gwenner // Acta biotechno. 1992. V. 12. № 6. P. 527-530.
. Киселев В.В. Дипломная работа по теме получение смешанных сорбентов на основе хитозана и природных цеолитов. 2000. ДВГУ.
. Шапкин Н.П. Отчет по теме модификация природных цеолитов в программе Дальний Восток России. 1997. ДВГУ. Владивосток. 5 с.
21. Harsa S.S. Harsa, S. Furasaki // Separ. Sci. and Techn. 1995. V. 30. №. 13. P. 2695 -2706.
22. Bray L.A., H.T. Fullam // Advan. Chem. Ser. 1971. V. 101. P. 450.
|
из
5.00
|
Обсуждение в статье: Определение сорбционной способности и коэффициентов распределения ионов при различной кислотности |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

