 |
Главная |
Зависимость скорости электрохимической реакции от потенциала. Поляризационные кривые
|
из
5.00
|
Скорость химической реакции изменяется с изменением потенциала. Сдвиг потенциала от равновесного значения, определяя скорость реакции, должен, очевидно, влиять на величину энергии активации. В этом заключается важнейшая особенность электродных реакций по сравнению с обычными химическими. Изменение потенциала, которое мы можем в известных пределах осуществлять по своему желанию, вызывает изменение энергии активации, т.е. изменяет и скорость процесса.
Удельную скорость электродной реакции удобно выражать через плотность тока. Для реакций окисления и восстановления на электродах можно записать следующие уравнения:
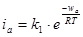
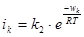 (1.5.1)
(1.5.1)
где  - энергия активации.
- энергия активации.
Если мы найдем связь между энергией активации  или
или 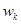 и сдвигом потенциала от равновесного значения
и сдвигом потенциала от равновесного значения 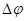 , то с помощью уравнения (1.5.1) можно определить зависимость между скоростями реакций
, то с помощью уравнения (1.5.1) можно определить зависимость между скоростями реакций 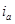 или
или 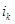 и
и 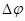 .
.
Величина работы А перехода 1 г-иона металла в раствор измеряется разностью потенциальной энергии катионов на поверхности электрода и сольватированных катионов в плотной части двойного слоя, находящихся на расстоянии 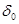 от поверхности электрода. В плотной части двойного слоя осуществляется скачок потенциала
от поверхности электрода. В плотной части двойного слоя осуществляется скачок потенциала 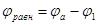 . Выражая величину А в электрических единицах, получим
. Выражая величину А в электрических единицах, получим
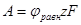 (1.5.2)
(1.5.2)
Величина 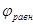 зависит от природы металла и концентрации ионов в двойном слое. Очевидно, что изменить потенциал металла можно, изменив строение двойного слоя, в частности, увеличив или уменьшив концентрацию ионов у поверхности электрода. Этого можно в известной мере добиться просто изменением концентрации раствора. Однако в данном случае такой вариант не подходит, так как новой концентрации будет отвечать новый равновесный потенциал, и реакции окисления протекать не будет. Также потенциал можно изменить и за счет приложения ЭДС от внешнего источника, причем через поверхность электрода протекает ток. Для этого должен быть использован вспомогательный электрод, и от какого-либо источника ЭДС между электродами должен быть пропущен ток. В зависимости от направления тока потенциал рассматриваемого электрода может быть сдвинут в сторону более положительных или более отрицательных значений от равновесного [5].
зависит от природы металла и концентрации ионов в двойном слое. Очевидно, что изменить потенциал металла можно, изменив строение двойного слоя, в частности, увеличив или уменьшив концентрацию ионов у поверхности электрода. Этого можно в известной мере добиться просто изменением концентрации раствора. Однако в данном случае такой вариант не подходит, так как новой концентрации будет отвечать новый равновесный потенциал, и реакции окисления протекать не будет. Также потенциал можно изменить и за счет приложения ЭДС от внешнего источника, причем через поверхность электрода протекает ток. Для этого должен быть использован вспомогательный электрод, и от какого-либо источника ЭДС между электродами должен быть пропущен ток. В зависимости от направления тока потенциал рассматриваемого электрода может быть сдвинут в сторону более положительных или более отрицательных значений от равновесного [5].
Измеряемый катодный ток определяется разность токов прямого и обратного направления:
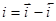 (1.5.3)
(1.5.3)
Поскольку ток обмена является частным значением токов 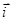 или
или 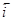 при
при 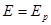 , уравнение (1.5.3) можно преобразовать к виду
, уравнение (1.5.3) можно преобразовать к виду
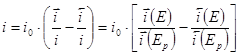 (1.5.4)
(1.5.4)
Так как функциональные зависимости 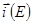 и
и 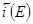 имеют вид
имеют вид 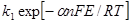 и
и 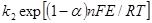 , то уравнение (1.5.4) можно записать в форме
, то уравнение (1.5.4) можно записать в форме
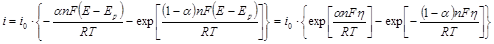 (1.5.5)
(1.5.5)
Где 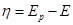 - катодное перенапряжение стадии разряда – ионизации.
- катодное перенапряжение стадии разряда – ионизации.
Уравнение (1.5.5) в сочетании с выражением для тока обмена является общим уравнением поляризационной кривой для одностадийной реакции разряда – ионизации. Проанализируем уравнение (1.5.5), предполагая, что 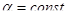 , а
, а 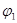 - потенциал достаточно мал для того, чтобы можно было пренебречь зависимостью
- потенциал достаточно мал для того, чтобы можно было пренебречь зависимостью 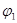 от
от 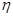 . При выполнении условия, что
. При выполнении условия, что 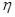 намного превышает значение
намного превышает значение 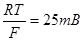 можно пренебречь второй экспонентой в уравнении (1.5.5), так что
можно пренебречь второй экспонентой в уравнении (1.5.5), так что
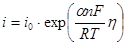 (1.5.6)
(1.5.6)
или
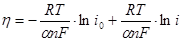 (1.5.7)
(1.5.7)
Вводя обозначения 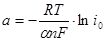 и
и 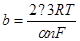 , уравнение (1.5.7) можно переписать в виде
, уравнение (1.5.7) можно переписать в виде
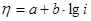 (1.5.8)
(1.5.8)
Уравнение (1.5.8) называют уравнением Тафеля. По наклону тафелевской прямой легко найти коэффициент переноса 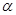 , а затем, учитывая связь константы
, а затем, учитывая связь константы 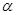 с
с 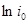 , определить ток обмена.
, определить ток обмена.
При больших анодных перенапряжениях, когда 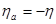 и намного превышает значение
и намного превышает значение 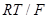 , из уравнения (1.5.5) следует
, из уравнения (1.5.5) следует
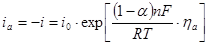 (1.5.9)
(1.5.9)
или
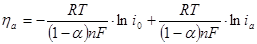 (1.5.10)
(1.5.10)
Уравнение (1.5.10) также имеет вид уравнения Тафеля.
В области малых перенапряжений, где 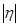 намного меньше значения
намного меньше значения 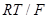 , можно разложить экспоненты в уравнении (1.5.5) и ограничиться первыми двумя членами разложения:
, можно разложить экспоненты в уравнении (1.5.5) и ограничиться первыми двумя членами разложения:
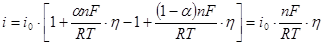 (1.5.11)
(1.5.11)
откуда
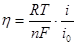 (1.5.12)
(1.5.12)
Таким образом, вблизи равновесного потенциала должна наблюдаться линейная зависимость между 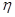 и
и 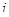 .
.
Из соотношения (1.5.12) видно, что чем больше ток обмена, тем меньше отклонение потенциала от его равновесного значения при данной плотности тока и наоборот. На основе уравнения (1.5.12) можно дать более строгое определение понятиям идеально поляризуемого и идеально неполяризуемого электродов. Так, идеально поляризуемый электрод – это такой электрод, плотность тока обмена на котором равна нулю: 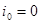 . Если бы не было двойного слоя, любой сколь угодно малый ток вызвал бы бесконечно большое смещение потенциала. Идеально неполяризуемый электрод – это электрод, которому отвечает бесконечно большой ток обмена:
. Если бы не было двойного слоя, любой сколь угодно малый ток вызвал бы бесконечно большое смещение потенциала. Идеально неполяризуемый электрод – это электрод, которому отвечает бесконечно большой ток обмена: 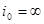 . Реальный ток обмена всегда имеет некоторую конечную величину. Но если
. Реальный ток обмена всегда имеет некоторую конечную величину. Но если 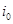 оказывается значительно больше протекающего через электрод тока
оказывается значительно больше протекающего через электрод тока 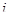 , то согласно уравнению (1.5.12) изменением потенциала этого электрода можно пренебречь. Так как при условии, что
, то согласно уравнению (1.5.12) изменением потенциала этого электрода можно пренебречь. Так как при условии, что 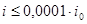 , сдвиг потенциала электрода не должен превышать 2,5 мкВ. Поэтому в качестве электродов сравнения обычно выбирают электрохимические системы с достаточно большими токами обмена. Если
, сдвиг потенциала электрода не должен превышать 2,5 мкВ. Поэтому в качестве электродов сравнения обычно выбирают электрохимические системы с достаточно большими токами обмена. Если 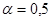 , то уравнение (1.5.5) преобразуется:
, то уравнение (1.5.5) преобразуется:
 (1.5.13)
(1.5.13)
Рассчитанная по (1.5.13) кривая 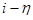 симметричная относительно начала координат (рис. 1.5.1). При отклонениях
симметричная относительно начала координат (рис. 1.5.1). При отклонениях 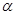 от 0,5 нарушается симметричность
от 0,5 нарушается симметричность  -кривой. Пунктиром на рис. 1.5.1 показаны поляризационные кривые, отвечающие зависимостям
-кривой. Пунктиром на рис. 1.5.1 показаны поляризационные кривые, отвечающие зависимостям 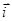 и
и 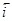 . При
. При 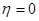
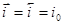 .
.
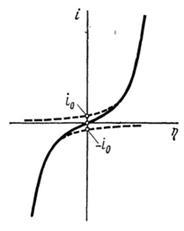
Рис. 1.5.1 - Поляризационная кривая стадии разряда – ионизации при 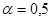 и
и 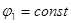
Поскольку в широком интервале потенциалов зависимость тока от перенапряжения носит экспоненциальный характер, обычно поляризационную кривую изображают в полулогарифмических координатах (рис. 1.5.2). Экстраполяция прямолинейных участков кривых для катодного и анодного перенапряжения до 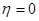 позволяет рассчитать ток обмена
позволяет рассчитать ток обмена 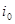 .
.
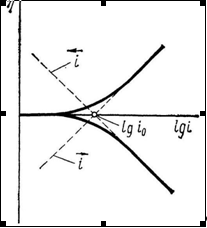
Рис. 1.5.2 - Поляризационная кривая стадии разряда – ионизации при 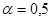 и
и 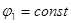 в полулогарифмических координатах
в полулогарифмических координатах
На практике редко встречаются простые электрохимические системы, для которых кинетические закономерности стадии разряда – ионизации можно было бы экспериментально изучить как вблизи равновесного потенциала, так и при значительном удалении от равновесного состояния. Это связано с различной зависимостью от потенциала диффузионной стадии электродного процесса и стадии разряда – ионизации. С одной стороны, после достижения предельного диффузионного тока скорость диффузионной стадии не зависит от потенциала. С другой стороны, по мере удаления от равновесного потенциала скорость стадии разряда – ионизации очень резко возрастает [7].
|
из
5.00
|
Обсуждение в статье: Зависимость скорости электрохимической реакции от потенциала. Поляризационные кривые |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

