 |
Главная |
Классификации дисперсных систем по размерам дисперсных частиц, агрегатным состояниям дисперсной фазы и дисперсионной среды.
|
из
5.00
|
Гетерогенные высокодисперсные системы характеризуются размерами частиц дисперсной фазы в интервале 10–5 – 10–7 см. Если интервал размера частиц ниже этого, происходит переход от агрегатов к отдельным молекулам, т.е. к истинным растворам. При диаметре частиц более 10 –5 см грубодисперсные системы называются микрогетерогенными. Это порошки, суспензии, эмульсии, пены и др. Микрогетерогенные системы, в соответствии с проявляемыми ими свойствами, также относятся к дисперсным, хотя подвижность крупных частиц в дисперсионной среде резко снижена. Отметим, что для названия систем, степень дисперсности частиц у которых лежит в коллоидной области, используется общий термин – золь.
Если в жидкости распределена твердая фаза, то система (Т/Ж) называется суспензией или коллоидной системой (в зависимости от интервала размеров частиц). Если фаза и среда представляют собой жидкости, то система (Ж/Ж) называется эмульсией, если дисперсионная среда газообразная, система (Ж/Г, Т/Г) носит название аэрозоль.Растворы высокомолекулярных (полимерных) органических соединений хотя и являются истинными, но по целому ряду проявляемых ими свойств очень сходны с коллоидными системами, и поэтому также являются предметом изучения коллоидной химии.
Системы, в которых энергетическое взаимодействие между дисперсной фазой и дисперсионной средой проявляется слабо (например, частицы металлов или галогенидов серебра в воде) называются лиофобными (или в водной среде – гидрофобными, т.е. не любящими воду). Если же в дисперсной системе интенсивность молекулярных взаимодействий на границе раздела фаз является сильно выраженной (например, в растворах ВМС, белков), то такие системы называются лиофильными (или в водной дисперсионной среде – гидрофильными, т.е. любящими воду). Коллоидными свойствами могут обладать системы и с неорганическими, и с органическими фазовыми компонентами. К дисперсным системам относятся как разнообразные природные объекты, так и многочисленные продукты их переработки, причем дисперсная фаза в них, как правило, полидисперсная, т.е. размеры частиц находятся в значительном интервале. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
| Дисперсионная среда | Дисперсная фаза | Название дисперсной системы | Примеры дисперсных систем |
|
Жидкость | Твердое тело | Суспензия, золь | Золи металлов, природные воды |
| Жидкость | Эмульсия | Молоко, нефть | |
| Газ | Пена | Мыльная пена | |
|
Твердое тело | Твердое тело | Минерал, сплав | Рубин, сталь |
| Жидкость | Пористое тело, минерал | Влажный грунт, опал | |
| Газ | Пористое тело | Сухой грунт, активированный уголь, пенопласт | |
| Газ | Твердое тело | Аэрозоль | Пыль, дым |
| Жидкость | Аэрозоль | Туман, облако |
61. Рассчитать средний сдвиг частиц аэрозоля с радиусом частиц 10-7 м за время 10 с при температуре 273 К и вязкости воздуха 1,7·10-5 н·с/м2. Как изменится средний сдвиг частиц, если радиус частиц аэрозоля увеличится до 10-6 м?
Средний сдвиг частиц аэрозоля

t - время, за которое происходит смещение частицы (продолжительность диффузии), с;
D- коэффициент диффузии, м2 . с-1.
Коэффициент диффузии для сферической частицырассчитывается по уравнению Эйнштейна:
 ,
,
где NА – число Авогадро, 6 · 10 23 молекул/моль;
h – вязкость дисперсионной среды, Н · с/м2 (Па · с);
r – радиус частицы, м;
R – универсальная газовая постоянная, 8,314 Дж/моль · К;
T – абсолютная температура, К;
p - число 3,14.

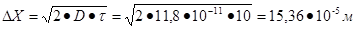
ответ на второй вопрос задания:

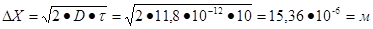
Таким образом, средний сдвиг частицы уменьшиться в 10 раз.
Ответ: 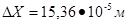 , уменьшится в 10 раз.
, уменьшится в 10 раз.
Объяснить причины, по которым определение количества адсорбирующегося вещества и описание адсорбционных явлений проводят с использованием нескольких теорий и уравнений: Гиббса, Ленгмюра, Фрейндлиха и др. В чем их особенности?
На границе раздела фаз, например жидкости и воздуха, молекулы вещества в глубине одной из фаз и на ее поверхности энергетически неравноценны. На молекулу внутри фазы со всех сторон действуют межмолекулярные силы, уравновешивающие друг друга. А на поверхностную молекулу со стороны дисперсной фазы, с одной стороны, и дисперсионной среды – с другой – действуют силы, разные по величине. Таким образом, на поверхности дисперсных частиц появляется избыточная энергия. Такая картина характерна для любых поверхностей раздела фаз. Чем больше поверхность раздела, тем больше накопленная поверхностная энергия в межфазном поверхностном слое. Это является причиной неустойчивости системы, поскольку в ней самопроизвольно могут протекать процессы, направленные всегда на снижение поверхностной энергии путем уменьшения величины удельной поверхности (например, капля жидкости всегда стремится принять форму шара, поскольку шар обладает минимальной площадью поверхности).
Величина поверхностной энергии определяется уравнением
F = s ·S,
где F – свободная поверхностная энергия, Дж;
s – величина поверхностного натяжения, Дж/м2;
S – поверхность дисперсных частиц (площадь поверхности раздела), м 2.
Самопроизвольные процессы, идущие с уменьшением площади поверхности S, называются коагуляцией, а процессы, идущие с уменьшением s, в частности при увеличении концентрации вещества в поверхностном слое по сравнению с концентрацией его в объеме фазы, называются адсорбцией.
Адсорбция – процесс самопроизвольного поглощения вещества (адсорбтива) поверхностью адсорбента. Уравнение Гиббса устанавливает взаимосвязь величины адсорбции (Г, кмоль/кг или кмоль/м 2) с изменением поверхностного натяжения (s, Дж/м2 ) от концентрации раствора (С, кмоль/л).
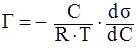 ,
,
где С – концентрация раствора, кмоль/л;
R – универсальная газовая постоянная;
T – температура;
ds /dС – производная, являющаяся мерой поверхностной активности; может быть определена графически по зависимости поверхностного натяжения от концентрации (при s®0).
Физические процессы молекулярной адсорбции на твердой поверхности описываются уравнениями Ленгмюра и Фрейндлиха.
Уравнение Ленгмюра:
 ,
,
где Г – величина адсорбции, кмоль/кг или кмоль/м2;
Гmax – величина предельной адсорбции, кмоль/кг (кмоль/м2);
С – концентрация раствора, кмоль/л;
а – константа равновесия адсорбции.
Это уравнение хорошо описывает адсорбцию для малых и больших концентраций растворов (или давлений газа).
Эмпирическое уравнение Фрейндлиха:
 ,
,
где Г – величина адсорбции, кмоль/кг (кмоль/м2);
n – количество вещества-адсорбтива, кмоль;
m – масса адсорбента, кг;
К – константа (при С = 1 моль/л К = Г);
1/а – константа (адсорбционный показатель); зависит от природы адсорбента и температуры. 1/а = 0,1–1.
Уравнение (2.11) хорошо описывает адсорбцию для интервала средних концентраций растворов (или давлений газа).
Адсорбция на жидкой поверхности может приводить как к уменьшению поверхностного натяжения (например, при адсорбции малорастворимых, дифильных поверхностно-активных веществ), так и к его увеличению (в частности, при адсорбции поверхностно-инактивных веществ, т. е. хорошо растворимых в воде неорганических электролитов) или не изменять его (растворы сахаров в воде). В последнем случае вещество распределяется равномерно между поверхностным слоем и объемом раствора.
87. Вычислить скорость электрофореза дисперсных частиц, если электрокинетический потенциал составляет 0,058 В, градиент напряжения внешнего поля равен 5·10-2 В/м, вязкость среды 10–3 Па·с, диэлектрическая проницаемость Е = 81 и электрическая константа 8,85·10-12 Ф/м.
Решение.
Величина дзета-потенциала (в вольтах) рассчитывается по формуле
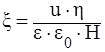 ,
,
где и – скорость передвижения границы золь-жидкости при электрофорезе, м/с;
 – вязкость дисперсионной среды, Па·с;
– вязкость дисперсионной среды, Па·с;
e – диэлектрическая проницаемость среды (для воды она равна 81);
eo – электрическая постоянная жидкости, равная 8,85·10–12 Ф/м;
Н – градиент напряженности внешнего поля, В/м.
Отсюда можно выразить скорость электрофореза:
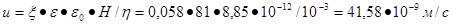
96. Рассчитать порог коагуляции раствора сульфата натрия, если добавление его 0,1 н раствора объемом 0,003 л вызывает коагуляцию золя объемом 0,015 л.
Порог коагуляции рассчитывается следующим образом:
 ,
,
где g порог коагуляции, кмоль/м- 3;
С – молярная концентрация раствора электролита, кмоль/м3;
Vэл – объем раствора электролита, м3;
Vзоля – объем золя, м3.

Ответ: 0,02
|
из
5.00
|
Обсуждение в статье: Классификации дисперсных систем по размерам дисперсных частиц, агрегатным состояниям дисперсной фазы и дисперсионной среды. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

