 |
Главная |
Расчет горения топлива
|
из
5.00
|
Основным топливом служит природный газ из групп северных месторождений Западной Сибири. Транспортируется он по газопроводу. Резервным топливо служит мазут. Для его использования имеется циркуляционный магистральный мазутопровод от мазутного хозяйства комбината до цеха, а также разводка его до каждой печи. В таблице 9 показан состав сухого газа.
Таблица 2 - Состав сухого газа
| СН4, % | С2Н6, % | С3Н8, % | С4Н8, % | N2, % | СО2, % | Сумма, % |
| 98,16 | 0,7 | 0,22 | 0,05 | 0,82 | 0,05 | 100 |
Топливо считается с коэффициентом расхода воздуха α = 1,14. Воздух, идущий на горение, нагревается до температуры 700°С.
Принимаем содержание влаги в воздухе 1,0%. Пересчитаем состав сухого газа на влажный рабочий газ:
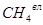
 = СН4∙(100-Н2О/100) = 98,16∙(100-1/100) = 97,18
= СН4∙(100-Н2О/100) = 98,16∙(100-1/100) = 97,18
Составляющие сводим в таблицу 3.
Таблица 3 - Состав влажного газа
СН4 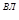 ,
,
%С2Н6 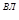 ,
,
%С3Н8 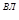 ,
,
%С4Н10 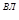 ,
,
%N2 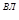 ,
,
%CO2 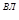 ,
,
%H2O 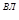 ,
,
%Сумма,
| % | |||||||
| 97,18 | 0,69 | 0,22 | 0,05 | 0,81 | 1,0 | 0,05 | 100 |
Определим теплоту сгорания газа по следующей формуле:

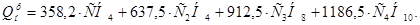 (1)
(1)
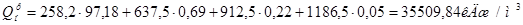
Находим теоретически необходимое количество сухого воздуха:
Lтеор=0,264/100∙ 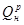 +∆L. (2)
+∆L. (2)
Находим теоретически необходимое количество воздуха с учетом его
влажности по формуле:
L´теор=1,016∙Lтеор. (3)
L´теор=1,016∙9,4 = 9,55 м³/м³
Действительное количество воздуха при коэффициенте расхода α = 1,14:
сухого: Lα= 1,14∙9,4 = 10,716 м³/м³;
атмосферного: L´α = 1,14∙9,55 = 10,887 м³/м³
Определим количество и состав продуктов горения при α = 1,14 по формулам:
VС02 = 0,01 ∙(СО2+СН4+2С2Н6+3С3Н8+4С4Н10). (4)
VС02=0,01∙(0,05+97,18+2∙0,69+3+0,22+4∙0,05) = 0,995 м³/м³
VН2О=0,01∙(Н20+2∙СН4+3∙С2Н6+4∙С3Н8+5∙С4Н10+0,16∙d∙Lα), (5)
где d - влагосодержание атмосферного воздуха, d=10г/кгс. в.
VН2О=0,01∙(1+2∙97,18+3∙0,69+4∙0,22+5∙0,05+0,16∙10∙10,72)=2,166 м³/м³
VN2=0,79∙Lα+0,01∙N2. (6)
VN2 = 0,79 ∙ 10,72 + 0,01 ∙ 0,81 =8,48 м³/м³
VO2 = 0,21 ∙ (α - 1) ∙ Lтеор. (7)
VO2 = 0,21 ∙ (1,14 - 1) ∙ 9,4 = 0,276 м³/м³
Общее количество продуктов горения составляет:
Vα = 0,995 + 2,166 + 8,48 +0,276 = 11,917 м³/м³
Находим процентный состав продуктов горения по формулам:
СО2 = (100 ∙ VСO2)/ Vα. (8)
СО2 = (100 ∙ 0,955)/ 11,917 = 8,3%;
Н2О = (100 ∙ VН2О)/ Vα. (9)
Н2О = (100 ∙ 2,166)/11,917 = 18,2%;
N2 = (100 ∙ VN2)/ Vα. (10)
N2 = (100 ∙ 8,48)/ 11,917 = 71,2%
О2 = 100∙VО2)/ Vα∙ L. (11)
О2 = (100 ∙ 0,276)/ 11,917 = 2,3%
Всего: 100%
Составляем материальный баланс процесса горения (таблица 4). Он необходим для определения количества воздуха, пошедшего на горение, и продуктов сгорания в результате горения.
Таблица 4 - Материальный баланс процесса горения
| Приход | кг | Расход | кг |
| природный газ: СН4 = 97,18 ∙ 0,717 С2Н6 = 0,69 ∙1,356 С3Н8 = 0,22 ∙ 2,020 С4Н10 = 0,05 ∙ 2,840 СО2 = 0,05 ∙ 1,977 Н2О = 1,0 ∙ 0,804 Воздух: О2 =9,43 ∙ 21 ∙1,14 ∙1,429 | 69,678 0,936 0,444 0,142 0,099 0,804 322,603 | продукт горения: СО2 = 0,995 ∙ 100∙ ∙1,977 Н2О = 2,166 ∙ 100∙ ∙0,804 N2 = 8,48 ∙100 ∙1.251 O2 = 0,276 ∙100 ∙1,429 Невязка: | 196,711 174,146 1060,848 39,440 -0,191 |
| N2 = 198.03 ∙ 1,14 ∙3,762∙ ∙1,251 Н2О = 0,16 ∙ 10∙10,72 ∙0,804 | 1062,458 13,790 | ||
| Итого: | 1470,954 | Итого: | 1470,954 |
Невязка баланса составляет: (100∙0,191):1470,954 = 0,013%
Определим теоретическую температуру горения. Для этого находим теплосодержание продуктов горения с учетом подогрева воздуха до температуры 700°С при α = 1,14.
По i-t-диаграмме находим теплоту нагрева атмосферного воздуха, iвозд = 960 кДж/м³.
Тогда iобщ = Qн/ Vα+Lα∙iвозд/Vα = 35509,84/11,917 + 10,887*960/11,917 = 3856,79 кДж/м³
По i-t-диаграмме при а = 1,14 теоретическая температура горения 1 теор = 2120°С, а калориметрическая температура горения tк = 2308°С.
Определим калометрическую температуру горения с помощью таблиц энтальпий, для этого задаемся температурами t1 = 2200°С и t2 = 2300°С. Теплота продуктов горения для температур t1 и t2 определяется с помощью приложения.
При T1 = 2200°С: При T2 = 2300°С:
СО2 = 0,080∙5387,0 = 430,96; СО2 = 0,080∙5658,7 = 452,70;
Н2О = 0,172∙4402,2 = 757,18; Н2О = 0,172∙4643,8 - 798,73;
N2 = 0,716∙3289,3 = 2355,14; N2 = 0,716∙3452,6 = 2472,06;
О2 = 0,032∙3482,7 = 111,45; О2 = 0,032∙3656,5 = 117,01;
il = 3654,73 кДж/м3. i2 = 3840,5 кДж/м3.
Следовательно, 3840,5> iобщ <3654,73
,79-3654,73 = 200,54
∆t = 200,54∙100/186 = 108, следовательно, tК = 2200+108 = 2308°С
Определим действительную температуру горения при коэффициенте η=0,8:
iдейст = iобщ∙η = 3856,79∙0,8 = 3084,2 кДж/м³
Действительная температура горения по i-t-диаграмме при α = 1,14 с учетом диссоциации равна 1810°С.
|
из
5.00
|
Обсуждение в статье: Расчет горения топлива |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

