 |
Главная |
Строение мышечного волокна
|
из
5.00
|
Каждое мышечное волокно представляет собой гигантскую многоядерную клетку – симпласт, образованную в процессе эмбрионального развития организма путем слияния множества отдельных клеток – миобластов.
Строение мышечного волокна существенно отличается от строения других клеток. Важнейшие отличительные особенности - это размеры, форма, многоядерность, наличие сократительного аппарата. Строение мышечного волокна представлено на рис. 60.
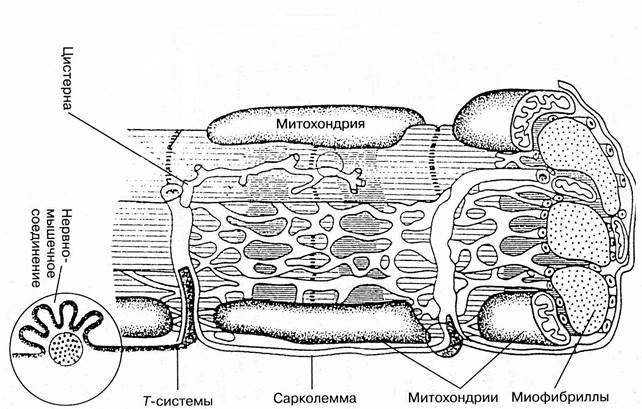
Рис. 60. Важнейшие структурные элементы мышечного волокна
Остановимся на важнейших структурных элементах мышечного волокна.
Сарколемма.Снаружи мышечное волокно окружено оболочкой – сарколеммой, обладающей высокой прочностью и эластичностью. Эти свойства сарколеммы обеспечиваются присутствием в ней большого количества эластичных волокон белков коллагена и эластина, образующих густую сеть.
Сарколемма обладает избирательной проницаемостью, пропуская внутрь клетки преимущественно те вещества, для превращения которых там имеются условия – ферментные системы. В сарколемме присутствуют специальные транспортные системы, с помощью которых поддерживается, в частности, разница в концентрации ионов Na+, К+, Сl‾ внутри и снаружи мышечного волокна, что обеспечивает формирование на его поверхности мембранного потенциала.
К каждому мышечному волокну подходит окончание двигательного нерва. Место прикрепления нервного окончания к мышечному волокну называется нервно-мышечным синапсом..
Внутри мышечного волокна находятся многочисленные клеточные органеллы, важнейшими из которых являются ядра, митохондрии, рибосомы и др. Функции указанных органелл описаны в главе 2 (2.5.1). Пространство между органеллами заполнено внутриклеточной жидкостью – саркоплазмой. Среди структурных элементов мышечного волокна наибольший объем занимают сократительные нити– миофибриллы.
Миофибриллы. Миофибриллы представляют собой длинные тонкие нити, расположенные вдоль мышечного волокна. Количество миофибрилл в мышечных волокнах может колебаться в диапазоне от нескольких десятков до полутора и более тысяч. Под влиянием систематической мышечной тренировки, особенно скоростно-силовой направленности, количество миофибрилл может увеличиваться. Напротив, ограничение двигательной активности сопровождается уменьшением количества миофибрилл. Строение мышечных миофибрилл представлено на рис. 61 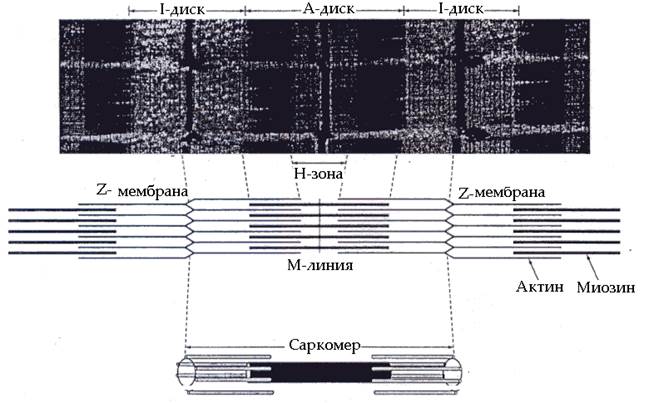 Рис. 61. Строение миофибрилл
Рис. 61. Строение миофибрилл
При рассмотрении в оптический микроскоп видно, что миофибриллы имеют повторяющуюся поперечную исчерченность – темные и светлые полосы (диски). Темные диски (А-диски) в центральной части имеют более светлую полосу (Н-зону). Светлые диски (I-диски) в центре пересекаются узкой темной полосой (линией Z). Участок миофибрилл между двумя линиями Z получил название саркомера. Количество саркомеров в миофибрилле зависит от длины мышечного волокна и может достигать нескольких сотен. Длина саркомеров у разных людей может различаться.
Исследование срезов мышечных волокон в электронном микроскопе показали, что каждая миофибрилла состоит из большого числа параллельно расположенных толстых и тонких нитей (филаментов), которые характеризуются строгим взаимным распределением. Толстые нити находятся в зоне А-дисков. Они построены из белка миозина. Миозин является важнейшим сократительным белком, на его долю приходится около 55% от общего количества сократительных белков. Молекула миозина имеет длинную фибриллярную (удлиненную) часть и глобулярную (округлой формы) головку. Фибриллярная часть имеет двухспиральную полипептидную конфигурацию. Функция фибриллярной части молекулы миозина связана с формированием структуры толстой миозиновой нити.
Глобулярные головки миозиновых нитей имеют два активных центра, один из которых обладает АТФ-азной активностью (способностью расщеплять молекулы АТФ), другой – способностью связываться с активными центрами на актиновых нитях (актинсвязывающий центр). Головки молекул миозина располагаются на поверхности миозиновых нитей, образуя выпячивания (отростки). При этом они строго ориентированы в пространстве – располагаются шестью продольными рядами. Толстая миозиновая нить состоит как бы из двух частей, зеркально повторяющих друг друга. Если ее разрезать по- середине, то образуются два совершенно одинаковых фрагмента.
Молекулы миозина обладают способностью связывать ионы Са2+ и Мg2+. Ионы кальция являются кофактором фермента АТФ-азы (в его отсутствии фермент не активен). Ионы магния обеспечивают миозину способность связывать молекулы АТФ и АДФ.
В зоне светлых дисков (I-дисков) расположены тонкие нити, построенные из белков актина, тропомиозина и тропонина. Актин – второй в количественном отношении сократительный белок, составляющий основу актиновых нитей. Тропомиозин – структурный белок актиновых нитей, имеющий фибриллярную форму. Сдвоенные молекулы тропомиозина обвивают актиновые нити. Тропонин является регуляторным белком актиновых нитей. Он существует в трех формах, одна из которых блокирует взаимодействие актина с миозином. Другая форма способна связывать ионы кальция, благодаря чему изменяется конформация молекул первой формы тропонина и открывается центр взаимодействия актина с миозином. Третья форма тропонина обеспечивает крепление первых двух форм на актиновой нити. Кроме того, в составе тонких актиновых нитей имеется белок актинин. Он содержится в зоне линии Z, выполняющей роль своеобразной перегородки, и обеспечивает прикрепление к ней концов актиновых нитей.
К числу важнейших структурных элементов мышечного волокна относится саркоплазматический ретикулум. Саркоплазматический ретикулум - это внутриклеточная система взаимосвязанных пузырьков и канальцев (цистерн), пронизывающих клетку и особенно плотно концентрирующихся в зоне соприкосновения актиновых и миозиновых нитей.
Саркоплазматический (в клетках других органов и тканей – эндоплазматический) ретикулум имеется в каждой клетке организма человека. Но в мышечном волокне он выполняет несколько необычные по сравнению с другими клетками функции. Основная его роль в мышечном волокне заключается в регуляции содержания ионов кальция возле актиновых и миозиновых нитей. В состоянии расслабления ретикулум связывает ионы Са2+, их концентрация в саркоплазме составляет примерно 10-7 моль·литр-1. Под воздействием двигательного импульса ионы кальция освобождаются из ретикулума и их концентрация повышается до 10-5 моль·литр-1.
Способность саркоплазматического ретикулума связывать и высвобождать в цитоплазму ионы Са2+ связана с локализацией на его внутренней поверхности особых кальций связывающих белков. На поверхности ретикулума располагаются также рибосомы – особые внутриклеточные образования, в которых осуществляется синтез белков.
Мышечное волокно имеет также систему трубчатых выпячиваний сарколеммы (Т-систему), направленных внутрь мышечного волокна и располагающихся между миофибриллами и саркоплазматическим ретикулумом. Т-система обеспечивает быстрое распространение волны возбуждения от сарколеммы вглубь волокна.
В мышечном волокне содержатся и другие внутриклеточные органеллы: митохондрии, лизосомы. Функции этих структур мышечного волокна уже были описаны в главе «Общие закономерности обмена веществ».
Мышечное волокно содержит не одно, а несколько ядер, которые располагаются не в центральной части волокна, а по периметру, непосредственно под сарколеммой
Типы мышечных волокон
В скелетных мышцах выделяют несколько типов мышечных волокон, различающихся по своим двигательным характеристикам, соотношению различных химических и структурных компонентов, особенностям структурной организации. К основным типам мышечных волокон относятся медленносокращающиеся (МС) и быстросокращающиеся (БС). Медленносокращающиеся волокна в связи с более высоким содержанием в них миоглобина называют еще красными (или тип I). Быстросокращающиеся, для которых характерно более низкое содержание миоглобина, называют белыми (или тип II). Следует сразу оговориться, что различить эти два типа волокон по цвету практически невозможно. Цвет у одних и у других красный.
Бытрые и медленные волокна более чем в два раза различаются по максимальной скорости сокращения. Так, время одиночного сокращения МС достигает 110 мс, а БС – 50 мс. Кроме того, БС более чем в два раза превышают МС по своим силовым характеристикам.
Существенно различаются разные типы волокон по уровню развития различных механизмов преобразования энергии. МС волокна имеют хорошо развитый механизм аэробного ресинтеза АТФ, что обеспечивается большим количеством митохондрий и высоким содержанием ферментов аэробного биологического окисления, а также большими запасами субстратов аэробного окисления: гликогена, жиров. В МС волокнах содержится больше белка миоглобина, благодаря которому они имеют больший запас кислорода и более благоприятные условия для перехода кислорода из крови внутрь волокна.
В БС волокнах значительно больше миофибрилл, выше АТФ-азная активность, больше концентрация ионов кальция.
Внутри БС волокон различают два подтипа: БСа и БСб. Эти два подтипа отличаются, главным образом, разным уровнем развития важнейших механизмов преобразования энергии. У волокон БСа более хорошо развит анаэробный гликолиз и несколько слабее, чем у МС волокон - аэробный путь ресинтеза АТФ. Они являются ведущими при выполнении упражнений т.н. субмаксимальной мощности, продолжительность которых колеблется в диапазоне от 30 сек до 2-3 мин, при условии выполнения работы с максимальной для данной продолжительности интенсивностью.
У волокон БСб, наряду с анаэробным гликолизом хорошо развит креатинфосфатный механизм ресинтеза АТФ. Они подключаются при выполнении упражнений максимальной и околомаксимальной интенсивности: бег на 100 м, упражнения с большими отягощениями и т.п.
Сказанное не означает, что упражнения указанной интенсивности, выполняются исключительно одним типом мышечных волокон. Речь идет о степени их вовлечения в работу, что, безусловно, определяется центральной нервной системой. Выполнение упражнений, мощность которых не превышает 20-25% от максимально возможной для данного индивидуума обеспечивается только «красными» мышечными волокнами. При работе, интенсивность которой находится в диапазоне 25-40% от максимальной, к ее выполнению подключаются волокна БСа. Если интенсивность упражнения превышает 40% от максимальной, в работу вовлекаются волокна БСб.
При повышении интенсивности упражнения в пределах каждой зоны мощности увеличивается участие в ее обеспечении волокон всех типов, но в наибольшей степени тех, которые подключаются к работе в данном диапазоне мощности.
Различные типы мышечных волокон различаются и условиями иннервации. Мотонейроны, иннервирующие БС мышечные волокна, более толстые, они имеют более разветвленную сеть нервных окончаний (ветвей аксонов), благодаря чему иннервируют значительно большее количество мышечных волокон (от300 до 500). У БС волокон больше зона прилегания нервного окончания к мышечному волокну, что создает более благоприятные условия для иннервации и возникновения потенциала действия.
|
из
5.00
|
Обсуждение в статье: Строение мышечного волокна |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

