 |
Главная |
Второй закон термодинамики (II коллоквиум)
|
из
5.00
|
ПРОГРАММА ПО КУРСУ ФИЗИЧЕСКОЙ ХИМИИ
ГРУППА ХИМИИ ЖИВЫХ СИСТЕМ
VII СЕМЕСТР
Первый закон термодинамики (I коллоквиум)
Термодинамические системы, их классификация, контрольная поверхность, окружающая среда. Термодинамические переменные и их классификации (внутренние и внешние, интенсивные и экстенсивные, обобщённые силы и обобщённые координаты). Термодинамические процессы: равновесные (квазистатические, обратимые) и необратимые. Внутренняя энергия как термодинамическая функция и её молекулярная интерпретация. Теплота и работа. Функции состояния и функции перехода. Постулат о равновесии. Постулат о существовании температуры (нулевой закон термодинамики). Абсолютная температура. МТШ-90.
Уравнения состояния идеального и реальных газов. Уравнение Ван-дер-Ваальса и его анализ. Критическая точка и критические параметры. Теорема о соответственных состояниях и проблема индивидуальных постоянных в уравнениях состояния. Вириальные уравнения состояния.
Первый закон термодинамики. Его формулировки, запись в дифференциальной и интегральной формах. Зависимость внутренней энергии от температуры и объёма. Энтальпия как функция состояния. Калорические и термические коэффициенты. Теплоёмкости. Их определение в термодинамике. Эмпирические уравнения для зависимости теплоёмкостей от температуры и их ограничения. Представления о теплоёмкости газов и кристаллических тел. Вычисление изменения внутренней энергии, энтальпии, а также теплоты и работы для различных процессов в газах: изотермического, изохорного, изобарного и адиабатического.
Термохимия. Понятие теплового эффекта химической реакции. Термохимические уравнения. Закон Гесса. Связь Qp и QV. Стандартное состояние и стандартные тепловые эффекты (энтальпии) химических реакций. Энтальпии образования и энтальпии сгорания. Средние энергии связей. Стандартные энтальпии образования в растворах. Их использование для расчёта тепловых эффектов (энтальпий) химических реакций. Зависимость тепловых эффектов (энтальпий) реакций от температуры. Уравнение Кирхгоффа в дифференциальной и интегральной формах.
Второй закон термодинамики (II коллоквиум)
Понятие самопроизвольного и несамопроизвольного процесса. Второй закон термодинамики, его различные формулировки и их взаимосвязь. Энтропия как тепловая координата состояния и функция состояния. Неравенство Клаузиуса. Некомпенсированная теплота и «потерянная работа». Изменение энтропии в различных обратимых и необратимых процессах. Фундаментальное уравнение Гиббса как объединённая запись первого и второго законов термодинамики.
Обоснование второго закона термодинамики по Карно−Клаузиусу. Цикл Карно в координатах p−V и T−S, коэффициент полезного действия тепловой машины. Теорема Карно–Клаузиуса. Понятие о методе Каратеодори.
Абсолютная температура и термодинамическая шкала температур.
Третий закон термодинамики: тепловая теорема Нернста, постулат Планка и область его применимости. Абсолютное значение энтропии. Вычисление энтропии идеального газа и реальных тел. Стандартная энтропия вещества. Энтропия реакции.
Математический аппарат термодинамики. Энергии Гельмгольца и энергии Гиббса. Запись для них фундаментальных уравнений. Соотношения Максвелла, их использование для расчёта изменение энтропии, внутренней энергии и энтальпии в различных обратимых процессах. Расчёт разности между Cp и CV в общем виде и для идеального газа.
Термодинамические потенциалы. Максимальная полезная работа. Характеристические функции, их определение и свойства. Естественные переменные. Условия равновесия и экстремумы характеристических функций. (Равновесие и самопроизвольный процесс на примере  ,
, 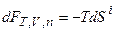 ) Условия стабильности. Уравнения Гиббса–Гельмгольца, их различные формы.
) Условия стабильности. Уравнения Гиббса–Гельмгольца, их различные формы.
Химический потенциал. Его определение через производные от различных термодинамических функций. Однородные функции. Теорема Эйлера. Внутренняя энергия - однородная функция объёма, энтропии и числа молей. Выражение для химического потенциала идеального газа. Стандартный химический потенциал Выражение для химического потенциала реального газа. Летучесть и её вычисление для реальных газов.
|
из
5.00
|
Обсуждение в статье: Второй закон термодинамики (II коллоквиум) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

