 |
Главная |
Расчет состава равновесных смесей протолитов при заданном рН
|
из
5.00
|
Рассмотрим двухосновную кислоту
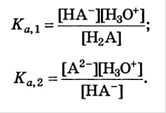
Уравнение материального баланса



Для одноосновной кислоты:

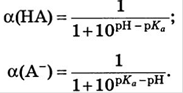
22. Расчет рН водных растворов сильных кислот и оснований, +при концентрации меньше, чем 10*-6

С > 10*-6, автопротолизом пренебрегаем

C < 10*-6


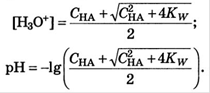
Для оснований


23. Кислотно-основные буферные растворы, уравнение Гендерсона-Хассельбаха. Общая характеристика. Принцип действия. Расчет рН буферного раствора. Буферная емкость.
Буферные растворы – системы, поддерживающие определенное значение какого-либо параметра (рН, потенциала системы и т.д.) при изменении состава системы.
Кислотно-основный называется буферный раствор, сохраняющий примерно постоянным значение рН при добавлении к нему не слишком больших количеств сильной кислоты или сильного основания, а также при разбавлении и концентрировании. Кислотно-основные буферные растворы содержат слабые кислоты и сопряженные с ним основания. Сильная кислота при добавлении к буферному раствору»превращается» в слабую кислоту, а сильное основание – в слабое основание. Формула для расчета рН буферного раствора: рН = рКо+ lg Cо /Сс Это уравнение Гендерсона – Хассельбаха. Из этого уравнения следует, что рН буферного раствора зависит от соотношения концентраций слабой кислоты и сопряженного с ней основания. Поскольку при разбавлении это соотношение не изменяется, то и рН раствора остается постоянным. Разбавление не может быть безграничным. При очень значительном разбавлении рН раствора изменится, так как, во-первых, концентрации компонентов встанут настолько малыми, что уже нельзя будет пренебречь автопротолизом воды, а во-вторых, коэффициенты активности незаряженных и заряженных частиц по-разному зависят от ионной силы раствора.
Буферный раствор сохраняет постоянные величины рН при добавлении лишь не очень больших количеств сильной кислоты или сильного основания. Способность буферного раствора «сопротивляться» изменению рН зависит от соотношения концентраций слабой кислоты и сопряженного с ней основания, а также от их суммарной концентрации – и характеризуется буферной емкостью.
Буферная емкость – отношение бесконечно малого увеличения концентрации сильной кислоты или сильного основания в растворе( без изменения объема) в вызванному этим увеличением изменению рН(стр.239, 7.79)
В сильнокислой и сильнощелочной среде буферная емкость значительно увеличивается. Растворы, в которых достаточно высока концентрация сильной кислоты или сильного основания, также обладают буферными свойствами.
Буферная емкость максимальна при рН=рКа. Для поддержания некоторого значения рН следует использовать такой буферный раствор, у которого величина рКа входящий в его состав слабой кислоты находится как можно ближе к этому рН. Буферный раствор имеет смысл использовать для поддержания рН, находящегося в интервале рКа+_ 1. Такой интервал называется рабочей силой буфера.
Основные понятия, связанные с комплексными соединениями. Классификация комплексных соединений. Константы равновесия, используемые для хар-ки комплексных соединений: константы образования, константы диссоциации (общие, ступенчатые, термодинамические, реальные и условные концентрационные)
Чаще всего комплексом называют частицу, образованную в рез-те донорно-акцепторного взаимодействия центрального атома(иона), называемого комплексообразователем, и заряженных или нейтральных частиц, называемых лигандами. Комплексообразователь и лиганды должны самостоятельно существовать в той среде, где происходит р-ция комплексообразования.
Комплексное соединение состоит из внутренней и внешней сфер. К3(Fe(CN)6)- К3-внешняя сфера, Fe-комплексообразователь, CN- лиганд, комплексообразователь+ лиганд=внутренняя сфера.
Дентатностью называется число донорных центров лиганда, участвующих в донорно-акцепторном взаимодействии при образовании комплексной частицы. Лиганды бывают монодентатными(Cl-, H2O, NH3), бидентатными( C2O4(2-), 1,10-фенантролин) и полидентатными.
Координационным числом называют число донорных центров лигандов, с которыми взаимодействует данный центральный атом. В выше указанном примере: 6-координационное число. (Ag(NH3)2)+ –координационное число 2, так как аммиак монодентатным лигандом, а в (Ag(S2O3)2)3- - координационное число 4, так как тиосульфат ион –бидентатный лиганд.
Классификация.
1)В зависимости от своего заряда: анионные( (Fe(CN)6)3-), катионными((Zn(NH3)4)2 +) и незаряженными или комплексы-неэлектролиты(HgCl2).
2)В зависимости от числа атомов металла: моноядерные и полиядерные комплексы. В состав моноядерного комплекса входит один атом металла, а в состав полиядерного- два и более. Полиядерные комплексные частицы, содержащие одинаковые атомы металла, называют гомоядерными(Fe2(OH)2)4+ или Be3(OH)3)3+), а содержащие атомы различных металлов- гетероядерными(Zr2Al(OH)5)6+).
3)В зависимости от хар-ра лигандов: однороднолигандные и разнолигандные (смешаннолигандные) комплексы.
Хелаты-циклические комплексные соединения ионов металлов с полидентатными лигандами(обычно органическими), в которых центральный атом входит в состав одного или нескольких циклов.

Константы. Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости.
Если справочные данные по ступенчатым константам нестойкости отсутствуют, пользуются общей константой нестойкости комплексного иона: 
Общая константа нестойкости равна произведению ступенчатых констант нестойкости.
В аналитической химии вместо констант нестойкости в последнее время пользуются константами устойчивости комплексного иона: 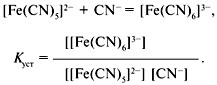
Константа устойчивости относится к процессу образования комплексного иона и равна обратной величине константы нестойкости: Куст = 1/Кнест.
Константа устойчивости характеризует равновесие образования комплекса.
Термодинамическая и концентрационная константы см. стр. 313.
Влияние различных факторов на процесс комплексообразования и устойчивость комплексных соединений (природа комплексообразователя и лиганда, температура, ионная сила, побочные реакции)
1)Устойчивость комплексных соединений зависит от природы комплексообразователя и лигандов. Закономерность изменения устойчивости многих комплексов металлов с различными лигандами можно объяснить с пом. Теории жестких и мягких кислот и оснований(ЖМКО): мягкие кислоты образуют более устойчивые соединения с мягкими основаниями, а жесткие- с жесткими.( напр., Al3+,B3+(ж. к-ты) образовывают комплексы с O- и N-сод. Лигандами(ж. основаниями), а Ag+ или Hg2+ (м. к-ты) с S-сод. Лигандами(м. осн.). Комплексы катионов металлов с полидентатными лигандами явл. Более устойчивыми, чем комплексы с аналогичными монодентатными лигандами.
2)ионная сила. При повышении ионной силы и уменьшения коэффициентов активности ионов устойчивость комплекса уменьшается.
3)температура. Если при образовании комплекса дельта Н больше 0, то при повышении температуры устойчивость комплекса увеличивается, если же дельта Н меньше 0, то уменьшается.
4)побочные р-ции. Влияние рН на устойчивость комплексов зависит от природы лиганда и центрального атома. Если в состав комплекса в качестве лиганда входит более или менее сильное основание, то при понижении рН происходит протонирование таких лигандов и уменьшение молярной доли формы лиганда, участвующей в образовании комплекса. Влияние рН будет тем сильнее, чем больше сила данного основания и чем меньше устойчивость комплекса
|
из
5.00
|
Обсуждение в статье: Расчет состава равновесных смесей протолитов при заданном рН |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

