 |
Главная |
Спин электрона. Принцип Паули
|
из
5.00
|
В настоящее время доказано, что кроме орбитального механического момента электрон обладает собственным моментом импульса. Собственный момент импульса называется спином. Собственный момент импульса электрона был обнаружен в опытах Штерна и Герлаха.
Целью опытов являлось измерение магнитных моментов атомов. Сущность опыта заключалась в следующем. Узкий пучок атомов пропускался через неоднородное магнитное поле. Для атомов с одним валентным электроном в s – состоянии собственный орбитальный механический и магнитный моменты раны нулю, следовательно, такой пучок атомов не должен испытывать отклонения в неоднородном магнитном поле. Но в опытах наблюдалось расщепление пучка на два, обусловленное пространственным квантованием спинового магнитного момента.
Спиновый момент импульса электрона определяется формулой
 . (1.10.1)
. (1.10.1)
Здесь s–спиновое квантовое число. Спиновое квантовое число имеет только одно значение
 . (1.10.2)
. (1.10.2)
Проекция спина на направление внешнего магнитного поля может принимать значения
 , (1.10.3)
, (1.10.3)
где  - магнитное спиновое число. Так как существует всего 2 ориентации спинового момента на направление внешнего поля, то mS = ±1/2.
- магнитное спиновое число. Так как существует всего 2 ориентации спинового момента на направление внешнего поля, то mS = ±1/2.
В связи с существованием спина электрона к квантовым числам n, l, m нужно добавить еще и квантовое число mS. Таким образом, состояние каждого электрона в атоме характеризуется набором четырех квантовых чисел:
§ главным квантовым числом n (n=1,2,3………);
§ орбитальным квантовым числом l (l =0,1,2…….n-1);
§ магнитным квантовым числом m (m =0, ±1,… ±l);
§ магнитным спиновым квантовым числом mS (mS = ±1/2) .
В 1925 г. Паули установил квантовомеханический закон, называемый принципом Паули или принципом исключения.
Простейшая формулировка принципа Паули заключается в следующем.
В любой системе, содержащей множество электронов, не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, l, m, mS:
 или 1 .
или 1 .
Принцип Паули справедлив для всех частиц, для которых  . Эти частицы называют фермионами.
. Эти частицы называют фермионами.
Спектр атома водорода
Изобразим схему уровней энергии атома водорода (рис.1.16).
Испускание и поглощение света происходит при переходе электрона с одного энергетического уровня на другой. В квантовой механике доказывается, что наиболее вероятны (возможны) только такие переходы, при которых изменение квантового числа l равно
 . (1.11.1)
. (1.11.1)
Это условие называется правилом отбора.
При переходе электронов излучается квант энергии, равный
 . (1.11.2)
. (1.11.2)
Здесь 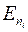 - энергия уровня, соответствующего значению главного квантового числа ni , ν – частота, λ – длина волны излучения. Формулу (1.11.2) можно представить в виде
- энергия уровня, соответствующего значению главного квантового числа ni , ν – частота, λ – длина волны излучения. Формулу (1.11.2) можно представить в виде
 , (1.11.3)
, (1.11.3)
где  .
.

Группа спектральных линий с одинаковыми n1 называется серией. Назовем некоторые серии линий спектра атомов водорода:
 – серия Лаймана, она находится в ультрафиолетовой части спектра.
– серия Лаймана, она находится в ультрафиолетовой части спектра.
 – серия Бальмера, она находится в видимой части спектра.
– серия Бальмера, она находится в видимой части спектра.
 - серия Пашена, она находится в инфракрасной части спектра.
- серия Пашена, она находится в инфракрасной части спектра.
На рис.1.16 изображены электронные переходы, соответствующие сериям Лаймана (1) и Бальмера (2) с учетом правил отбора(1.11.1).
Формулу (1.11.3) можно записать в виде
 , (1.11.4),
, (1.11.4),
где  . (1.11.5)
. (1.11.5)
Выражение (1.11.4) называется сериальной формулой. Величина R называется постоянной Ридберга; ранее она была установлена экспериментально; ее численное значение равно  , что совпадает с вычисленным по формуле (1.11.5).
, что совпадает с вычисленным по формуле (1.11.5).
|
из
5.00
|
Обсуждение в статье: Спин электрона. Принцип Паули |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

