 |
Главная |
Металлический цирконий и его сплавы
|
из
5.00
|
Содержание
· 1 История и происхождение названия
· 2 Нахождение в природе
o 2.1 Месторождения
· 3 Получение
· 4 Физико-химические свойства
· 5 Биологическая роль и физиологическое действие
· 6 Применение циркония и его соединений
o 6.1 Металлический цирконий и его сплавы
§ 6.1.1 Ядерная энергетика
§ 6.1.2 Легирование
§ 6.1.3 Пиротехника
§ 6.1.4 Сверхпроводник
§ 6.1.5 Конструкционный материал
§ 6.1.6 Медицина
§ 6.1.7 Быт
o 6.2 Соединения
· 7 Изотопы
· 8 Примечания
История и происхождение названия
Цирко́ний в виде двуокиси впервые был выделен в 1789 году немецким химиком М. Г. Клапротом в результате анализа минерала циркона.
В свободном виде цирконий впервые был выделен шведский химиком Берцелиусом в 1824 году. Свободный от примесей чистый цирконий удалось получить лишь в начале ХХ века[3].
Происхождение самого слова циркон неясно. Возможно, оно происходит от арабского zarkûn (киноварь) или от персидского zargun (золотистый цвет).
Нахождение в природе
Соединения циркония широко распространены в литосфере. По разным данным кларк циркония от 170 до 250 г/т. Концентрация в морской воде 5·10−5 мг/л[4]. Цирконий — литофильный элемент. В природе известны его соединения исключительно с кислородом в виде окислов и силикатов. Несмотря на то, что цирконий рассеянный элемент, насчитывается около 40 минералов, в которых цирконий присутствует в виде окислов или солей. В природе распространены главным образом циркон(ZrSiO4)(67,1 % ZrO2), бадделеит (ZrO2) и различные сложные минералы (эвдиалит (Na, Ca)5(Zr, Fe, Mn)[O,OH,Cl][Si6O17] и др.). Во всех земных месторождениях цирконию сопутствует Hf, который входит в минералы циркона благодаря изоморфномузамещению атома Zr.
Циркон является самым распространенным циркониевым минералом. Он встречается во всех типах пород, но главным образом в гранитах и сиенитах. В графстве Гиндерсон (штат Северная Каролина) в пегматитах были найдены кристаллы циркона длиной в несколько сантиметров, а на Мадагаскаре были обнаружены кристаллы, вес которых исчисляется килограммами.
Бадделеит был найден Юссаком в 1892 году в Бразилии, основное месторождение находится в районе Посус-ди-Калдас. Там была найдена глыба бадделеита весом около 30 т, а в водных потоках и вдоль обрыва бадделеит встречается в виде аллювиальной гальки диаметром до 7,5 мм, известной под названием фавас (от португ. fava — боб). Фавас обычно содержит свыше 90 % двуокиси циркония[5].
Месторождения
Наиболее крупные месторождения циркония расположены на территории США, Австралии, Бразилии, Индии[6].
В России, на долю которой приходится 10 % мировых запасов циркония (3 место в мире после Австралии и ЮАР), основными месторождениями являются: Ковдорское коренное бадделит-апатит-магнетитовое в Мурманской области, Туганское россыпное циркон-рутил-ильменитовое в Томской области, Центральное россыпное циркон-рутил-ильменитовое в Тамбовской области, Лукояновское россыпное циркон-рутил-ильменитовое в Нижегородской области, Катугинское коренное циркон-пирохлор-криолитовое в Читинской области и Улуг-Танзекское коренное циркон-пирохлор-колумбитовое[7].
Получение
В промышленности исходным сырьем для производства циркония являются циркониевые концентраты с массовым содержанием диоксида циркония не менее 60-65 %, получаемые обогащением циркониевых руд.
Основные методы получения металлического циркония из концентратов — хлоридный, фторидный и щелочной процессы.
Хлоридный процесс основан на перевод циркония в летучий тетрахлорид ZrCl4 (Tсублимации 331 °C) с дальнейшей его очисткой и последующим металлотермическим восстановлениеммагнием в циркониевую губку. Используются два варианта хлорирования концентратов: прямое хлорирование смеси циркониевых концентратов с коксом хлорируют при 900—1000 °С и хлорирование предварительно полученных спеканием концентратов с коксом смеси карбидов и карбонитридов циркония при 400—900 °С:


При фторидном методе на первой стадии циркониевый концентрат спекают с гексафторсиликатом калия при 600—700 °С:

Образовавшийся гексафторцирконат калия выщелачивают горячей водой и очищают фракционной перекристаллизацией от примеси гексафторгафната K2HfF6, после чего металлический цирконий получают электролизом расплава смеси гексафторцирконата калия и хлоридов калия и натрия.
Щелочной процесс является методом получения технически чистого диоксида циркония ZrO2, из которого металлический цирконий получают хлоридным или фторидным методом. В этом процессе цирконий переводится в растворимую форму спеканием концентрата с гидроксидом натрия при 600—650 °С, карбонатом натрия при 900—1100 °С либо со смесью карбоната и хлорида кальция при 1000—1300 °С, после чего образовавшиеся цирконаты натрия Na2ZrO3 или кальция CaZrO3 выщелачиваются соляной либо серной кислотами:
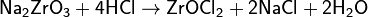

Водные растворы хлорида или сульфата цирконила далее очищаются и гидролизуются, осадок ZrO(OH)2 прокаливают и получают технический диоксид циркония ZrO2.
Физико-химические свойства
Цирконий — блестящий серебристо-серый металл. Существует в двух кристаллических модификациях:
· α-Zr — с гексагональной решёткой типа магния (а = 3,231 Å; с = 5,146 Å; z = 2; пространственная группа P63/mmc)
· β-Zr — с кубической объёмноцентрированной решёткой типа α-Fe (a = 3,61 Å; z = 2; пространственная группа Im3m). Переход α ↔ β происходит при 863 °C, ΔH перехода 3,89 кДж/моль. Добавки Al, Sn, Pb, Cd повышают, а Fe, Cr, Ni, Mo, Cu, Ti, Mn, Co, V и Nb понижают температуру перехода[2].
Плотность α-циркония при 20 °C равна 6,5107 г/см³; температура плавления Tпл — 1855 °C[2]; температура кипения Tкип — 4409 °C; удельная теплоёмкость (25-100 °C) 0,291 кДж/(кг·К) или 0,0693 кал/(г·°C), коэффициент теплопроводности (50 °C) 20,96 Вт/(м·К) или 0,050 кал/(см·сек·°C); температурный коэффициент линейного расширения (20-400 °C) 6,9·10−6; удельное электрическое сопротивление циркония высокой степени чистоты (20 °C) 44,1 мкОм·см. температура перехода в состояние сверхпроводимости 0,7 К[8].
Цирконий парамагнитен; удельная магнитная восприимчивость увеличивается при нагревании и при −73 °C равна 1,28·10−6, а при 327 °C — 1,41·10−6. Сечение захвата тепловых нейтронов 0,18·10−28 м² (0,18 барн), примесь гафния увеличивает это значение, поэтому для изготовления твэлов применяется цирконий, хорошо очищенный от гафния. Чистый цирконий пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке). Наличие растворённых в металле малых количеств кислорода, азота, водорода иуглерода (или соединений этих элементов с цирконием) вызывает хрупкость циркония. Модуль упругости (20 °C) 97 ГН/м² (9700 кгс/мм²); предел прочности при растяжении 253 МН/м² (25,3 кгс/мм²); твёрдость по Бринеллю 640—670 МН/м² (64-67 кгс/мм²); на твёрдость очень сильное влияние оказывает содержание кислорода: при концентрации более 0,2 % цирконий не поддаётся холодной обработке давлением.
Внешняя электронная конфигурация атома циркония 4d25s2. Для циркония характерна степень окисления +4. Более низкие степени окисления +2 и +3 известны для циркония только в его соединениях с хлором, бромом и иодом.
Компактный цирконий медленно начинает окисляться в пределах 200—400 °C, покрываясь плёнкой циркония двуокиси ZrO2; выше 800 °C энергично взаимодействует с кислородомвоздуха. Порошкообразный металл пирофорен — может воспламеняться на воздухе при обычной температуре. Цирконий активно поглощает водород уже при 300 °C, образуя твёрдый раствор и гидриды ZrH и ZrH2; при 1200—1300 °C в вакууме гидриды диссоциируют и весь водород может быть удалён из металла. С азотом цирконий образует при 700—800 °C нитрид ZrN. Цирконий взаимодействует с углеродом при температуре выше 900 °C с образованием карбида ZrC. Карбид и нитрид циркония — твёрдые тугоплавкие соединения; карбид циркония — полупродукт для получения хлорида ZrCl4. Цирконий вступает в реакцию со фтором при обычной температуре, а с хлором, бромом и иодом при температуре выше 200 °C, образуя высшие галогениды ZrHal4 (где Hal — галоген).
Цирконий устойчив в воде и водяных парах до 300 °C, при более высоких температурах (начиная с примерно 700 °C) начинается экзотермическая пароциркониевая реакция
Zr + 2H2O = ZrO2 + 2H2,
которая имеет важное значение при развитии аварий в ядерных реакторах с водным теплоносителем и/или замедлителем[9].
Не реагирует с соляной и серной (до 50 %) кислотами, а также с растворами щелочей (цирконий — единственный металл, стойкий в щелочах, содержащих аммиак). С азотной кислотойи царской водкой он взаимодействует при температуре выше 100 °C. Растворяется в плавиковой и горячей концентрированной (выше 50 %) серной кислотах. Из кислых растворов могут быть выделены соли соответствующих кислот разного состава, зависящего от концентрации кислоты. Так, из концентрированных сернокислых растворов циркония осаждается кристаллогидрат Zr(SO4)2·4H2O; из разбавленных растворов — основные сульфаты общей формулы xZrO2·ySO3·zH2O (где х : y > 1). Сульфаты циркония при 800—900 °C полностью разлагаются с образованием двуокиси циркония. Из азотнокислых растворов кристаллизуется Zr(NO3)4·5H2O или ZrO(NO3)2·xH2O (где x = 2-6), из солянокислых растворов — ZrOCl2·8H2O, который обезвоживается при 180—200 °C.
Биологическая роль и физиологическое действие
Цирконий не играет биологической роли в организме. Металлический цирконий и его нерастворимые соединения (оксид, силикат) обладают высокой биологической инертностью (свойством никак не взаимодействовать с тканями и жидкостями организма благодаря химической стойкости). О воздействии соединений циркония на организм ничего не известно. Пыль циркония представляет собой вещество с большой пожаро- и взрывоопасностью, поскольку может самовоспламениться на воздухе.
Циркониевые браслеты, рекламировавшиеся В.Кикабидзе и якобы снижающие артериальное давление, не оказывают реального терапевтического воздействия[10], их возможное субъективное действие объясняется эффектом плацебо.
Применение циркония и его соединений
В промышленности цирконий стал применяться с 30-х годов XX века. Из-за высокой стоимости его применение ограничено.
Единственным предприятием, специализирующемся на производстве циркония в России (и на территории бывшего СССР), является Чепецкий механический завод (Глазов, Удмуртия). Цирконий производится также на Украине Государственным научно-производственным предприятием «Цирконий», в городе Днепродзержинск Днепропетровской области.
Металлический цирконий и его сплавы
Ядерная энергетика
Цирконий имеет очень малое сечение захвата тепловых нейтронов и высокую температуру плавления. Поэтому металлический цирконий, не содержащий гафния, и его сплавыприменяются в атомной энергетике для изготовления тепловыделяющих элементов, тепловыделяющих сборок и других конструкций ядерных реакторов.
Легирование
В металлургии применяется в качестве лигатуры. Хороший раскислитель и деазотатор, по эффективности превосходит Mn, Si, Ti. Легирование сталей цирконием (до 0,8 %) повышает их механические свойства и обрабатываемость. Делает также более прочными и жаростойкими сплавы меди при незначительной потере электропроводности.
Пиротехника
Цирконий обладает замечательной способностью сгорать в кислороде воздуха (температура самовоспламенения — 250 °C) практически без выделения дыма и с высокой скоростью. При этом развивается самая высокая температура для металлических горючих (4650 °C). За счет высокой температуры образующаяся двуокись циркония излучает значительное количество света, что используется очень широко в пиротехнике (производство салютов и фейерверков), производстве химических источников света, применяемых в различных областях деятельности человека (факелы, осветительные ракеты, осветительные бомбы, ФОТАБ — фотоавиабомбы; широко применялся в фотографии в составе одноразовых ламп-вспышек, пока не был вытеснен электронными вспышками). Для применения в этой сфере представляет интерес не только металлический цирконий, но и его сплавы с церием, дающие значительно больший световой поток. Порошкообразный цирконий применяют в смеси с окислителями (бертолетова соль) как бездымное средство в сигнальных огнях пиротехники и в запалах, заменяя гремучую ртуть и азид свинца. Проводились удачные эксперименты по использованию горения циркония в качестве источника света для накачки лазера.
Сверхпроводник
Сверхпроводящий сплав 75 % Nb и 25 % Zr (сверхпроводимость при 4,2 K) выдерживает нагрузку до 100 000 А/см².
|
из
5.00
|
Обсуждение в статье: Металлический цирконий и его сплавы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

