 |
Главная |
Определение восстановителей
|
из
5.00
|
1. Прямое титрование раствором KMnO4 в кислой среде ¾ применяют, если реакция идёт быстро.
2. Обратное титрование избытка KMnO4 раствором H2C2O4 ¾ применяют, если реакция идёт медленно, чаще ¾ для органических веществ.
Схема определения:
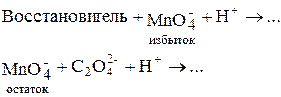
Определение окислителей
1. Обратное титрование избытка восстановителя ¾ рабочего раствора Fe2+ ¾ раствором KMnO4 по схеме:
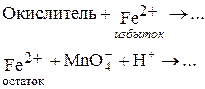
2. Титрование заместителя (рабочий раствор KMnO4, вспомогательный раствор ¾ раствор подходящего восстановителя, например, Sn2+):

Определение веществ, не обладающих
Окислительно-восстановительными свойствами
Ионы металлов осаждают в виде оксалатов, затем титруют раствором KMnO4 связанные с металлом оксалат-ионы (титрование заместителя) либо остаток оксалата после реакции с металлом (обратное титрование.
1. Титрование заместителя:

2. Обратное титрование:

Определение органических веществ в щелочной среде
В щелочной среде органические вещества окисляются перманганатом до карбонатов (полное окисление) или до других продуктов (неполное окисление). Эти реакции идут очень медленно, поэтому прямое титрование провести невозможно и используют обратное титрование.
1. Обратное титрование:
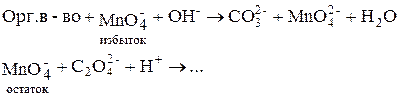
Недостаток этой схемы анализа заключается в том, что визуально трудно зафиксировать к. т. т. Действительно, образуется 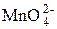 зелёного цвета, остаётся
зелёного цвета, остаётся  фиолетового цвета, может выпасть бурый осадок MnO2, идут реакции диспропорционирования с участием марганца в различных степенях окисления и т. д.
фиолетового цвета, может выпасть бурый осадок MnO2, идут реакции диспропорционирования с участием марганца в различных степенях окисления и т. д.
2. «Двойное» обратное титрование. Часто после реакции (…) раствор подкисляют, добавляют избыток H2C2O4 и затем титруют остаток её раствором KMnO4:

Иодометрия
Метод был впервые предложен Дюпаскье в 1840 г., затем развит в работах Бунзена (1853 г.) и Шварца (1953 г.), который ввёл применение тиосульфата. Метод основан на использовании полуреакции:

В нём используют окислительные свойства I2и восстановительные свойства I¾. Основной реакцией метода, кроме того, является реакция взаимодействия йода с тиосульфатом:
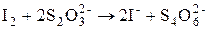
Рабочие растворы метода: I2 и Na2S2O3.
Вспомогательные растворы метода:
ü KI ¾ для определения окислителей способом замещения;
ü Смесь KI и KIO3 ¾ для определения кислот способом замещения;
ü H2SO4 ¾ для подкисления.
Фиксирование к. т. т.:
ü безындикаторное титрование ¾ применяется редко;
ü с применением специфического индикатора крахмала, который образует с I2 окрашенное в синий цвет соединение.
Достоинства метода. Метод обладает высокой точностью, обусловленной высокой чувствительностью индикатора. Основные реакции метода идут без участия ионов Н+, поэтому потенциал пары I2/I¾ не зависит от рН, что позволяет проводить титрование в широком интервале значений рН 2¾10. Можно определять многие вещества, в т. ч. те, которые неудобно титровать более сильными окислителями KMnO4 и K2Cr2O7.
Недостатки метода. I2 ¾ достаточно дорогой препарат; рабочие растворы метода неустойчивы; существует много различных источников погрешностей.
Причины занижения результатов анализа в иодометрии ¾ улетучивание I2; незавершённость реакции, если реакционную смесь выдерживали недостаточно долго.
Причины завышения результатов анализа в иодометрии ¾ частичное разложение тиосульфата в растворе; частичное разложение крахмала; преждевременное добавление индикатора.
Приготовление и стандартизация рабочего раствора I2
I2 плохо растворим в воде, поэтому его растворяют в воде с добавлением КI, который увеличивает растворимость и понижает летучесть йода за счёт образования трийодидного комплекса:
I2 + КI ® K[I3]
Обычно готовят раствор йода с молярной концентрацией эквивалента 0,05 моль/л по точной навеске I2 (как первичный стандарт) либо как вторичный стандарт (устанавливают точную концентрацию по стандартному раствору Na2S2O3). Концентрацию приготовленного раствора I2 надо регулярно проверять, т. к. она быстро меняется.
Причины неустойчивости рабочего раствора I2:
ü летучесть I2, что приводит к уменьшению концентрации;
ü взаимодействие I2 с органическими примесями, что также приводит к уменьшению концентрации;
ü окисление I¾ кислородом воздуха (особенно на свету):

Этот процесс приводит к увеличению концентрации йода в растворе, поэтому рабочий раствор хранят в тёмной, закрытой посуде.
Приготовление и стандартизация рабочего раствора Na2S2O3
Этот раствор всегда готовят как вторичный стандарт. Точную концентрацию устанавливают по стандартным растворам KMnO4, K2Cr2O7, I2 и т. д. через 1¾2 дня после приготовления. Затем контролируют концентрацию еженедельно.
Причины неустойчивости рабочего раствора Na2S2O3:
ü взаимодействие с компонентами воздуха (СО2, О2);
ü разложение в кислой среде (при рН < 4) и на свету;
ü разложение тиобактериями.
|
из
5.00
|
Обсуждение в статье: Определение восстановителей |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

