 |
Главная |
Этапы синтеза и созревания коллагена
|
из
5.00
|
Синтез и созревание коллагена — сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе:
1. На полисомах ЭПР синтезируются полипептидные препро-α-цепи коллагена. Они содержит начиная с N-конца: 1). гидрофобный «сигнальный» пептид, содержащий около 100 АК; 2). N-концевой пропептид, содержащий около 100 АК, в том числе цистеин; 3). α-цепь коллагена 4). С-концевой пропептид, содержащий около 250 АК, в том числе цистеин. Концевые С- и N-пропептиды формируют глобулярные домены и необходимы для правильного формирования тройной спирали. «Сигнальный» пептид, обеспечивает поступление синтезируемой на рибосоме препро-α-цепи в полость ЭПР.
2. В полости ЭПР при отщеплении сигнального пептида препро-α-цепи коллагена превращаются в про-α-цепи.
3. Поступающие в полости ЭПР про-α-цепи коллагена подвергаются модификации.
а). Цистеины N-пропептидов образуют внутрицепочечные дисульфидные мостики, формируя на N-конце глобулярную структуру;
б). Пролины и лизины в Y-положении (гли-х-у) про-α-цепей гидроксилируются пролил-4-гидроксилазой и лизил-5-гидроксилазой в 4-гидроксипролины (Hyp) и 5-гидроксилизины (Hyl). Некоторые пролины в Х-положениях гидроксилируются в 3-гидроксипролины пролил-3-гидроксилазой. Оксигеназы (гидроксилазы), содержат Fe2+, находятся на мембране ЭПР. Для реакции необходимы а-КГ, О2 и витамин С:

Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина участвуют в образовании водородных связей.
Гидроксилирование лизина необходимо для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл.
в). Гидроксилизин про-α-цепей при участии гликозилтрансфераз гликозилируется галактозой или галактозилглюкозой. В молекуле коллагена сухожилий (тип I) количество углеводов равно 6, а в моллекуле коллагена капсулы хрусталика (тип TV) — 110. Роль этих углеводных групп неясна.
4). В просвете ЭПР после отделения от рибосом про-α-цепей, 3 из них с помощью С-концевых пропептидов соединяются между собой дисульфидными мостиками (цистеины С-пропептидов образуют внутри- и межцепочечные дисульфидные мостики) и скручиваются с образованием тройной спирали проколлагена. Тройная спираль проколлагена стабилизируется водородными связями. После этого гидроксилирование и гликозилирование про-α-цепей прекращается.
5). Из ЭПР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
6). В межклеточном матриксе от некоторых проколлагенов (I, II, III, V, XI типов) проколлагенпептидазы отщепляют концевые С- и N-пропептиды, в результате чего образуется тропоколлагены. У проколлагенов IV, VIII, X типов концевые пропептиды не отщепляются.
Химический состав межклеточного матрикса
В состав межклеточного матрикса входят: 1). Коллагеновыеиэластиновые волокна. Они придают ткани механическую прочность, препятствуя ее растяжению; 2). аморфное вещество в виде ГАГ и протеогликанов. Оно удерживает воду и минеральные вещества, препятствует сдавливанию ткани; 3). неколлагеновые структурные белки - фибронектин, ламинин, тенасцин, остеонектин и др. Кроме того, в межклеточном матриксе может присутствовать минеральный компонент - в костях и зубах: гидроксиапатит, фосфаты кальция, магния и т.д. Он придает механическую прочность костям, зубам, создает запас в организме кальция, магния, натрия, фосфора.
Функция межклеточного матрикса
Межклеточный матрикс выполняет в организме разнообразные функции:
· образует каркас органов и тканей;
· является универсальным «биологическим» клеем;
· участвует в регуляции водно-солевого обмена;
· образует высокоспециализированные структуры (кости, зубы, хрящи, сухожилия, базальные мембраны).
· окружая клетки, влияет на их прикрепление, развитие, пролиферацию, организацию и метаболизм.
Эластин — основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веществе кожи, стенок кровеносных сосудов, связках, лёгких. Эти ткани могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв.
Строение эластина
Эластин — гликопротеин с молекулярной массой 70 кДа.
Первичная структура эластина образована полипептидной цепью из 800 АК, в которой преобладают глицин, валин, аланин, содержится много пролина и лизина, немного гидроксипролина, отсутствует гидроксилизин.
Большое количество гидрофобных радикалов препятствует созданию регулярной вторичной и третичной структуры эластина, поэтому он приобретает различные конформации.
В межклеточном пространстве молекулы эластина образуют волокна и слои, в которых отдельные пептидные цепи связаны множеством жёстких поперечных сшивок в разветвлённую сеть. Сшивки между остатками лизина двух, трёх или четырёх пептидных цепей, образуют специфические структуры, которые называются десмозинами (десмозин или изодесмозин).
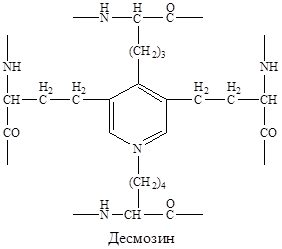
| Десмозины образуются следующим образом: вначале 3 остатка лизина окисляются до альдегидов, а затем происходит их соединение с четвёртым остатком лизина с образованием замещённого пиридинового кольца. Окисление остатков лизина в альдегиды осуществляется лизилоксидазой (РР, В6, Cu2+). |
Кроме десмозинов, в образовании поперечных сшивок может участвовать лизиннорлейцин, который образуется двумя остатками лизина.
Наличие ковалентных сшивок между пептидными цепочками с неупорядоченной, случайной конформацией позволяет всей сети волокон эластина растягиваться и сжиматься в разных направлениях, придавая соответствующим тканям свойство эластичности.
Синтез эластина
Эластин синтезируется фибробластами в виде растворимого мономера - «тропоэластина». В межклеточном пространстве после образования поперечных сшивок эластин приобретает свою конечную внеклеточную форму, которая характеризуется нерастворимостью, высокой стабильностью и очень низкой скоростью обмена.
Нарушения структуры эластина и их последствия
Снижение активности лизилоксидазы, вызванное дефицитом меди, пиридоксина или дефицит лизилоксидазы, связанный с генетическим дефектом, приводит к снижению или прекращению образования десмозинов. В результате поперечных сшивок нет или их недостаточное количество. При этом, у эластических тканей снижается предел прочности на разрыв, появляются такие нарушения, как истончённость, вялость и растяжимость. Клинически эти нарушения могут проявляться кардиоваскулярными изменениями (аневризмы и разрывы аорты, дефекты клапанов сердца), частыми пневмониями и эмфиземой лёгких.
Катаболизм эластина
Катаболизм эластина происходит при участии эластазы нейтрофилов. Это очень активная протеаза, которая выделяется во внеклеточное пространство нейтрофилами и разрушает эластин и другие структурные белки. Особое значение это имеет в лёгких, поскольку лёгочная ткань не регенерирует. Разрушение эластина в альвеолярных стенках ведёт к потере эластичных свойств, разрушению альвеол и развитию эмфиземы лёгких.
В норме эластазу нейтрофилов и другие протеазы ингибирует α1-антитрипсин. Основное количество α1-антитрипсина синтезируется печенью и находится в крови. В лёгких α1-антитрипсин синтезируется альвеолярными макрофагами, что и обеспечивает защиту альвеол от действия эластазы. При дефиците α1-антитрипсина, который может быть следствием различных мутаций, повышается риск развития эмфиземы лёгких.
|
из
5.00
|
Обсуждение в статье: Этапы синтеза и созревания коллагена |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

