 |
Главная |
Очистка белков от низкомолекулярных примесей
|
из
5.00
|
Применение в определенной последовательности ряда перечисленных мето-
дов позволяет получить белок в очищенном состоянии, не лишенный,
однако, некоторых примесей солей. Для полного освобождения белков от
низкомолекулярных примесей в настоящее время используют методы
диализа, гельхроматографии, кристаллизации, ультрафильтрации. При диа-
лизе применяют полупроницаемые мембраны (целлофан, коллодийная
пленка), диаметр пор которых варьирует в широких пределах. Белки, как
правило, не диффундируют через такую мембрану, в то время как низкомо-
лекулярные вещества легко проникают через нее в окружающую среду.
Метод кристаллизации белков основан на достижении критической
точки начала осаждения белка из раствора сульфата аммония при мед-
ленном повышении температуры. Уже получены сотни кристаллических
белков *. Однако не всякий кристаллический белок является гомогенным,
поскольку при одной и той же концентрации раствора сульфата аммония
могут кристаллизоваться близкие по размерам и массе разные белки.
Наилучшие результаты при освобождении белков от низкомолекуляр-
ных примесей получают с помощью гельхроматографии и ультрафильтра-
ции. Последняя основана на продавливании растворов белка через спе-
циальные мембраны, задерживающие белковые молекулы, что позволяет не
только освободить белковые растворы
Определение гомогенности белков
На заключительном этапе выделения и очистки белков исследователя
всегда интересует вопрос о гомогенности полученного белка. достоверные результаты при определении
гомогенности белка дают ультрацентрифугирование в градиенте плотности
сахарозы или хлорида цезия, диск-электрофорез в полиакриламидном геле,
изоэлектрическое фокусирование, иммунохимические методы и определение
растворимости белка.
Хромопротеины. Структура гема.
К группе гемопротеинов относятся гемоглобин и его производные, миогло-
бин, хлорофиллсодержащие белки и ферменты (вся цитохромная система,
каталаза и пероксидаза). Все они содержат в качестве небелкового компо-
нента структурно сходные железо- (или магний)порфирины, но различные
по составу и структуре белки, обеспечивая тем самым разнообразие их
биологических функций. Далее более подробно рассмотрено химическое
строение гемоглобина, наиболее важного для жизнедеятельности человека
и животных соединения.
Гемоглобин в качестве белкового компонента содержит глобин, а не-
белкового – гем. Видовые различия гемоглобина обусловлены глобином,
в то время как гем одинаков у всех видов гемоглобина.
Основу структуры простетической группы большинства гемосодержа-
щих белков составляет порфириновое кольцо, являющееся в свою очередь
производным тетрапиррольного соединения – порфирина. Последний со-
стоит из четырех замещенных пирролов:
соединенных между собой метиновыми мостиками (—СН=). Незамещен-
ный порфирин называется порфином. В молекуле гема порфин представлен
в виде протопорфирина IX, содержащего четыре метильные группы
(—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой
кислоты. Протопорфирин, присоединяя железо, превращается в гем.
ФОСФОПРОТЕИНЫ
К белкам этого класса относятся казеиноген молока, в котором содержание
фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин,
выделенные из желтка куриного яйца; овальбумин, открытый в белке
куриного яйца; ихтулин, содержащийся в икре рыб, и др. Большое коли-
чество фосфопротеинов содержится в клетках ЦНС. Фосфопротеины зани-
мают особое положение в биохимии фосфорсодержащих соединений не
только в результате своеобразия структурной организации, но и вследствие
широкого диапазона функций в метаболизме. Характерной особенностью
структуры фосфопротеинов является то, что фосфорная кислота оказы-
вается связанной сложноэфирной связью с белковой молекулой через
гидроксильные группы β-оксиаминокислот, главным образом серина
и в меньшей степени треонина. На одну молекулу белка обычно приходится
2–4 остатка фосфата.
Новые данные свидетельствуют о том, что в клетках фосфопротеины
синтезируются в результате посттрансляционной модификации, подвер-
гаясь фосфорилированию при участии протеинкиназ. Этот процесс под-
робно рассматривается в главе 14. Здесь лишь укажем на существенную
роль специфической протеинкиназы, катализирующей фосфорилирование
ОН-группы тирозина, в биосинтезе онкобелков. Таким образом, уровень
фосфопротеинов в клетке зависит в значительной степени от регулирую-
щего действия ферментов, катализирующих фосфорилирование (протеин-
киназы) и дефосфорилирование (протеинфосфатазы). Следует отметить, что
фосфопротеины содержат органически связанный, лабильный фосфат, аб-
солютно необходимый для выполнения клеткой ряда биологических функ-
ций. Кроме того, они являются ценным источником энергетического и
пластического материала в процессе эмбриогенеза и дальнейшего постна-
тального роста и развития организма.
Особо следует отметить, что некоторые ключевые ферменты, регули-
рующие процессы внутриклеточного обмена веществ, также существуют
как в фосфорилированной, так и в дефосфорилированной форме. Этим
подчеркивается значение фосфорилирования–дефосфорилирования в про-
цессах химической модификации макромолекул, участвующих в интеграль-
ных процессах метаболизма.
ЛИПОПРОТЕИНЫ
Этот класс сложных
белков состоит из белка и простетической группы, представленной каким-
либо липидом.
Хиломикроны состоят преимущественно из триглицеридов, причем, как мы знаем, из экзогенных триглицеридов, транспортной формой в крови которых они и являются.
Липопротеины очень низкой плотности также главным образом содержат триглицериды, но эндогенного происхождения и являются их транспортной формой в крови.
Липопротеины низкой плотности в своем составе в норме содержат до 45% холестерина, что преобладает над другими типами липидов в данном классе липопротеидов, поэтому данные липопротеины рассматривают как транспортную форму холестерина в крови.
Липопротеины высокой плотности содержат больше всего фосфолипидов и являются их транспортной формой.
В крови здорового человека, взятой натощак, содержатся только липопротеиды высокой, низкой и очень низкой плотности. Хиломикроны в ней отсутствуют. Они появляются только при нарушениях липидного обмена.
В ряде патологических состояний в крови может обнаруживаться пятый класс липопротеинов — липопротеиды промежуточной плотности. Обычно они представляют собой промежуточные продукты превращения липопротеинов очень низкой и низкой плотности. Синтезируются липопротеиды высокой и очень низкой плотности в печени, а низкой — в плазме крови из липопротеидов очень низкой плотности.
Все классы липопротеидов в большей или меньшей мере содержат холестерин. Но наиболее атерогенными из них являются ЛПНП и ЛППП. Единственный неатерогенный класс липопротеидов — это липопротеиды высокой плотности. Более того, они активно участвуют в выведении холестерина из клеток путем этерификации его, что облегчает доставку холестерина в печень, откуда он в составе желчи выводится в кишечник и удаляется из организма. Все другие классы, наоборот, транспортируют холестерин в клетки.
Кроме того, липопротеиды высокой плотности являются транспортной формой фосфолипидов в крови. Фосфолипиды способствуют поддержанию холестерина во взвешенном состоянии, препятствуя его выпадению из кровяного русла.
ГЛИКОПРОТЕИНЫ
Гликопротеины– сложные белки, содержащие, помимо простого белка или
пептида, группу гетероолигосахаридов. В состав гликоконъюгата входит угле-
водный компонент (гликановая фракция), ковалентно связанный с неугле-
водной частью (агликановая фракция), представленной белком, пептидом,
аминокислотой или липидом.
МЕТАЛЛОПРОТЕИНЫ
К металлопротеинам относятся биополимеры, содержащие, помимо белка,
ионы какого-либо одного металла или нескольких металлов (табл. 2.5).
К таким белкам принадлежат, например, белки, содержащие негемовое
железо, а также белки, координационно связанные с атомами металлов
в составе сложных белков-ферментов.
Амфотерность.
Белки, как и аминокислоты, амфотерны благодаря наличию свободных
NH2- и СООН-групп. Для них характерны все свойства кислот и оснований.
В зависимости от реакции среды и соотношения кислых и основных
аминокислот белки в растворе несут или отрицательный, или положитель-
ный заряд, переемещаясь к аноду или катоду.
Мононуклеотид.
структурными единицами нуклеиновых кислот являются
мономерные молекулы – мононуклеотиды.
Полиморфизм белков.
У разных особей возникают варианты (мутации) разных генов или варианты одного и того же гена. Варианты генов, образующиеся у отдельных особей, могут постепенно распространяться в популяции в результате наследования, если они не летальны. Так формируется генотипическая неоднородность популяции, которая ведет и к фенотипической неоднородности. На молекулярном уровне фено-типическая неоднородность проявляется как полиморфизм белков — существование разных форм белка, выполняющих одинаковые или очень сходные функции (изобелки)
Два белка – гемоглобин1 и миоглобин – часто называют дыхательными ферментами (рис. 1). Оба этих вещества выполняют роль переносчиков при дыхании: гемоглобин – основной компонент красных кровяных телец2 (эритроцитов), переносящих по артериям кислород из легких к тканям; миоглобин – красный белок в мышцах, принимающий кислород от гемоглобина и хранящий его там до того момента, когда он потребуется для окисления пищевых веществ. Эти процессы в организме сопряжены с одновременным переносом углекислого газа, переправляемого из тканей в легкие, в основном в виде бикарбоната. Перенос бикарбоната и углекислого газа идет также при содействии гемоглобина. 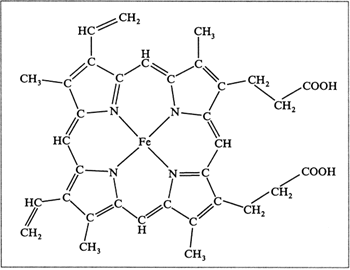
ФУНКЦИИ БЕЛКОВ
Белки выполняют множество самых разнообразных функций, характерных
для живых организмов, с некоторыми из которых мы познакомимся более
подробно при дальнейшем изучении курса. Ниже рассматриваются главные
и в некотором смысле уникальные биологические функции белков, несвой-
ственные или лишь частично присущие другим классам биополимеров.
Каталитическая функция.К 1995 г. было идентифицировано более
3400 ферментов. Большинство известных в настоящее время ферментов,
называемых биологическими катализаторами, является белками. Эта функ-
ция белков, хотя и не оказалась уникальной, определяет скорость химиче-
ских реакций в биологических системах *.
Транспортная функция.Дыхательная функция крови, в частности перенос
кислорода, осуществляется молекулами гемоглобина – белка эритроцитов.
В транспорте липидов принимают участие альбумины сыворотки крови.
Ряд других сывороточных белков образует комплексы с жирами, медью,
железом, тироксином, витамином А и другими соединениями, обеспечивая
их доставку в соответствующие органы-мишени.
Защитная функция.Основную функцию защиты в организме выполняет
иммунная система, которая обеспечивает синтез специфических защитных
белков-антител в ответ на поступление в организм бактерий, токсинов,
вирусов или чужеродных белков. Высокая специфичность взаимодействия
антител с антигенами (чужеродными веществами) по типу белок-белковое
взаимодействие способствует узнаванию и нейтрализации биологического
действия антигенов. Защитная функция белков проявляется и в способности
ряда белков плазмы крови, в частности фибриногена, к свертыванию.
В результате свертывания фибриногена образуется сгусток крови, предохра-
няющий от потери крови при ранениях.
Сократительная функция.В акте мышечного сокращения и расслабления
участвует множество белковых веществ. Однако главную роль в этих
жизненно важных процессах играют актин и миозин – специфические белки
мышечной ткани. Сократительная функция присуща не только мышечным
белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы
жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Структурная функция.Белки, выполняющие структурную (опорную)
функцию, занимают по количеству первое место среди других белков тела
человека. Среди них важнейшую роль играют фибриллярные белки, в част-
ности коллаген в соединительной ткани, кератин в волосах, ногтях, коже,
эластин в сосудистой стенке и др. Большое значение имеют комплексы
белков с углеводами в формировании ряда секретов: мукоидов, муцина
и т.д. В комплексе с липидами (в частности, с фосфолипидами) белки
участвуют в образовании биомембран клеток.
Гормональная функция.Обмен веществ в организме регулируется разно-
образными механизмами. В этой регуляции важное место занимают гормо-
ны, синтезируемые не только в железах внутренней секреции, но и во
многих других клетках организма (см. далее). Ряд гормонов представлен
белками или полипептидами, например гормоны гипофиза, поджелудочной
железы и др. Некоторые гормоны являются производными аминокислот.
Питательная (резервная) функция.Эту функцию выполняют так назы-
ваемые резервные белки, являющиеся источниками питания для плода,
например белки яйца (овальбумины). Основной белок молока (казеин)
также выполняет главным образом питательную функцию. Ряд других
белков используется в организме в качестве источника аминокислот, кото-
рые в свою очередь являются предшественниками биологически активных
веществ, регулирующих процессы метаболизма.
Можно назвать еще некоторые другие жизненно важные функции бел-
ков. Это, в частности, экспрессия генетической информации, генерирование
и передача нервных импульсов, способность поддерживать онкотическое
* Получены экспериментальные доказательства, что, помимо белков, ферментативной,
каталитической активностью наделен и ряд других макромолекул, в частности РНК (названы
рибозимами) и моно- и поликлональные антитела (абзимы) – см. главу ≪Ферменты≫.
давление в клетках и крови, буферные свойства, поддерживающие физио-
логическое значение рН внутренней среды, и др.
Таким образом, из этого далеко не полного перечня основных функций
белков видно, что указанным биополимерам принадлежит исключительная
и разносторонняя роль в живом организме. Если попытаться выделить
главное, решающее свойство, которое обеспечивает многогранность биоло-
гических функций белков, то следовало бы назвать способность белков
строго избирательно, специфически соединяться с широким кругом разно-
образных веществ. В частности, эта высокая специфичность белков (срод-
ство) обеспечивает взаимодействие ферментов с субстратами, антител
с антигенами, транспортных белков крови с переносимыми молекулами
других веществ и т.д. Это взаимодействие основано на принципе биоспе-
цифического узнавания, завершающегося связыванием фермента с соответ-
ствующей молекулой субстрата, что содействует протеканию химической
реакции. Высокой специфичностью действия наделены также белки, кото-
рые участвуют в таких процессах, как дифференцировка и деление клеток,
развитие живых организмов, определяя их биологическую индивидуальность.__
|
из
5.00
|
Обсуждение в статье: Очистка белков от низкомолекулярных примесей |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

