 |
Главная |
АТОМНАЯ ТЕОРИЯ ОТРОЕНИЯ ВЕЩЕСТВА. ФОТОЭЛЕКТРИЧЕСКИЙ ЭФФЕКТ
|
из
5.00
|
ФОТОЭЛЕКТРИЧЕСКИЙ ЭФФЕКТ
ПОСТОЯННАЯ ПЛАНКА
АТОМ БОРА
КВАНТОВАЯ МЕХАНИКА
ПОЛОСНАЯ ТЕОРИЯ
ТВЕРДОТЕЛЬНОЙ
ПРОВОДИМОСТИ
Выбивание светом электронов с поверхности токопроводящих материалов — явление, широко используемое сегодня в повседневной жизни. Например, некоторые системы сигнализации работают за счет передачи видимых или инфракрасных световых лучей на фотоэлектрический элемент, из которого выбиваются электроны, обеспечивающие электропроводность цепи, в которую он включен. Если на пути светового луча появляется препятствие, свет на датчик поступать перестает, поток электронов прекращается, цепь разрывается — и срабатывает электронная сигнализация.
Это явление, получившее название фотоэлектрического эффекта, или кратко фотоэффекта, было открыто в конце XIX столетия и сразу поставило целый ряд фундаментальных вопросов, поскольку ничего из того, что было известно ученым о строении металлов или природе света, фотоэффекта не объясняло. Нельзя сказать, что классическая теория запрещала бы свету выбивать электроны из металла. Электромагнитные волны по идее могли «вымывать» электроны из металла подобно тому, как морские волны выносят на поверхность и постепенно прибивают к берегу легкие пробковые крошки. Однако проблема состояла в том, что столь простым объяснением в случае фотоэффекта ограничиться было невозможно. Во-первых, электроны появлялись практически мгновенно после начала облучения. Во-вторых, фотоэффект, как оказалось, возникал даже под воздействием самых слабых световых лучей, причем по мере повышения интенсивности облучения энергия высвобождаемых электронов не изменялась. И то и другое вступало в явное противоречие с классической картиной взаимодействия света с электронами.
Проблему в конце концов удалось решить в начале ХХ века Альберту Эйнштейну, причем сделанные им выводы дали мощный толчок развитию квантовой механики. Незадолго до этого Макс Планк показал, что излучение черного тела можно адекватно описать, приняв за допущение, что атомы излучают и поглощают свет фиксированными энергетическими порциями — квантами. Он полагал, что этот феномен каким-то образом обусловлен внутренним строением атомов, но отнюдь не природой света. Однако Эйнштейн воспринял идею Планка гораздо серьезнее и постулировал, что сам свет распространяется дискретными пучками энергии, которые он назвал фотонами. иногда фотоны ведут себя подобно частицам, иногда — подобно волнам (см. принцип дополнительности). В частности, при взаимодействии с электроном фотон может вести себя как частица и буквально выбивать электрон из атома (это соударение фотона с атомом можно уподобить столкновению двух бильярдных шаров). Причем для выбивания электрона при таком соударении достаточно единственного фотона. Далее, повышение интенсивности света приводит к увеличению числа фотонов (и, следовательно,
числа выбитых электронов), но не энергии отдельно взятого фотона. Следовательно, и энергия, и скорость отдельно взятого выбитого фотоэлектрона не зависят от интенсивности света — но только от его частоты.
Рассуждая таким образом, Эйнштейн вывел следующее простое уравнение для описание энергии фотоэлектронов:
Е = Иу - ф,
где у — частота падающего света, И — постоянная планка, а ф — так называемая «работа выхода», то есть минимальная энергия, необходимая для того, чтобы выбить электрон из атома металла.
Химические связи
Атомы могут присоединяться друг к другу, либо отдавая и принимая электроны, либо делясь парами электронов с соседними атомами, либо делясь электронами со многими другими атомами, либо благодаря эффекту поляризации
1854 • КАТАЛИЗАТОРЫ И ФЕРМЕНТЫ
1887 • КИСЛОТЫ
| • |
И ОСНОВАНИЯ
ПРАВИЛО ОКТЕТА
| 1930-е |
кон. • ТЕОРИЯ 1920-х МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
ХИМИЧЕСКИЕ СВЯЗИ
Электроны в атоме занимают ряд вложенных слоев (см. атом бора), при этом воздействию другого атома могут подвергаться, как правило, только электроны, находящиеся во внешнем слое (он называется валентным слоем). Когда электроны в двух атомах выстраиваются так, что возникает сила, удерживающая вместе эти два атома, мы говорим, что образуется химическая связь. Различают несколько видов химической связи.
Ионная связь
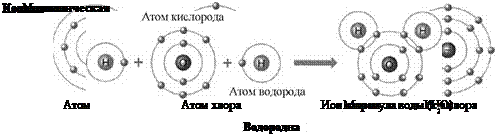
Когда внешние электронные слои полностью заполнены, общая энергия атомов понижается. Например, атом натрия, имеющий на внешнем слое один электрон, охотно отдает этот электрон. И наоборот, атом хлора, которому не хватает одного электрона для заполнения внешнего слоя, стремится присоединить электрон для завершения уровня. Когда атомы натрия и хлора оказываются рядом, натрий отдает электрон, а хлор его принимает. При этом атом натрия, потеряв отрицательный заряд, становится положительно заряженным ионом натрия, а атом хлора, получив дополнительный электрон, становится отрицательно заряженным ионом хлора. По закону кулона между двумя ионами возникает электростатическое притяжение, приводящее к образованию химической связи, которая и удерживает атомы вместе (см. также правило октета).
С этой реакцией связано одно из чудес химии: бурно реагирующее вещество натрий и сильно ядовитый газ хлор, соединяясь, образуют обычную поваренную соль, широко применяемую в питании.
Ковалентная связь
Некоторые атомы, в основном это касается углерода, образуют связи по-другому. Когда два таких атома достаточно приближаются друг к другу, между ними возникает взаимодействие, которое можно рассматривать как длительный взаимный обмен электронами. Как будто атом бросает один из своих внешних электронов другому атому, затем ловит электрон другого атома и снова бросает его обратно в бесконечной игре в мяч. В соответствии с законами квантовой механики такой обмен электронами вызывает силу притяжения, которая и удерживает атомы вместе.
Дело в том, что такой атом, как углерод, имеющий четыре электрона во внешнем слое, может дополнить этот валентный слой до восьми электронов, образуя ковалентные связи с четырьмя другими атомами. Поэтому атомы углерода способны образовывать молекулы с длинными цепями, какие мы наблюдаем в биологических системах. Некоторые ученые (и я в том числе) даже утверждают, что вследствие этого свойства атома углерода вся жизнь во Вселенной, как и жизнь на Земле, должна быть углеродной.
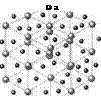
Металлическая связь
В металлах образуется химическая связь еще одного вида. Каждый атом в металле отдает один или два подвижных электрона, как бы делясь этими электронами со всеми соседними атомами металла. Эти квазисвободные электроны образуют что-то вроде желе, в котором располагаются тяжелые положительные ионы металла. Все это напоминает трехмерную пространственную решетку из стеклянных шариков в вязкой патоке — если толкнуть один из таких шариков, он слегка сдвинется, но сохранит свое положение относительно других. Точно так же атомы металла, потревоженные внешним механическим воздействием, останутся связанными друг с другом благодаря «электронному желе» (или «электронному газу»). Вот почему, если ударить по металлу молотком, останется вмятина, но сам кусок металла, скорее всего, не разломится. Именно «электронное желе» делает металлы хорошими проводниками электричества (см. электронная теория
Химическая связь определяется расположением электронов в атомах по отношению к другим электронам и ядру, а также электростатическим притяжением между положительными и отрицательными зарядами
проводимости).
Водородная связь
Строго говоря, это не химическая связь в том смысле, в каком мы рассматривали предыдущие три типа связи. Это, скорее, притяжение между отдельными молекулами. Многие молекулы хотя и являются в целом нейтральными (то есть имеют одинаковое коли-
 | |||
 | |||
связь
связь
чество отрицательных электронов и положительных протонов в своем ядре), оказываются поляризованными. Это значит, что некоторые части таких молекул имеют суммарный отрицательный заряд, в то время как другие части — положительный. Конечно, суммарный заряд молекулы нейтрален, но положительный и отрицательный заряды распределены неравномерно.
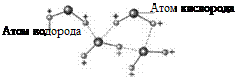
Представим, что полярная молекула, как ее называют, приближается своей отрицательной областью к молекуле-мишени. Электростатическая сила со стороны этой отрицательной области больше, чем со стороны положительной, т.к. положительная область расположена дальше. Эта электростатическая сила вызывает в молекуле-мишени передвижение электронов прочь от точки контакта, тем самым создавая в этом месте молекулы-мишени незначительный положительный заряд. В результате между двумя молекулами возникает сила притяжения и, следовательно, образуется связь.
Самая известная полярная молекула — это молекула воды. Отрицательный заряд собирается вокруг атома кислорода, приводя к образованию слабого положительного заряда около атомов водорода. Благодаря такой поляризации вода является хорошим растворителем. Ее молекулы способны создавать связи более прочные, чем те, которые удерживают молекулы-мишени вместе. Связи, создаваемые посредством положительно заряженных атомов водорода, называются водородными связями. Поскольку молекул водорода очень много в биологических молекулах, водородные связи в них образуются достаточно часто. В частности, именно водородные связи удерживают вместе две спирали молекулы ДНК.
|
из
5.00
|
Обсуждение в статье: АТОМНАЯ ТЕОРИЯ ОТРОЕНИЯ ВЕЩЕСТВА. ФОТОЭЛЕКТРИЧЕСКИЙ ЭФФЕКТ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

