 |
Главная |
Синтез сульфата тетрааминмеди (II)
|
из
5.00
|
Кристаллогидрат (моногидрат) сульфата тетраамминмеди (II) синтезируют действием аммиака на раствор сульфата меди (II):
CuSO4 + H2O + 4NH3 = [Cu(NH3)4]SO4·H2O.
Реактивы:
1)Пентагидрат сульфата меди (II) – 5г
2)25%-й раствор аммиака – 10мл
3)Этиловый спирт – 30 мл
Оборудование:
1) Весы технохимические
2) Фарфоровая ступка
3) Печь
4) Воронка со стеклянным пористым фильтром (пористость 100)
5) Шпатель
6) Стеклянная палочка
7) Чашка Петри
8) Стакан на 50 мл, мерные цилиндры ёмкостью 50, 25, 10 мл,
9) Комплект пробирок
10) Спиртовка
11) Фильтры бумажные
Ход работы.
1. Взвесили 5 грамм медного купороса, мелко растертого в фарфоровой ступке, перенесли его в химический стакан емкостью 50 мл и прилили 10 мл воды. Слегка нагрели смесь до полного растворения соли, а затем охладили раствор до комнатной температуры(Он имеет светло-голубой цвет)
2.Добавили в него раствор аммиака и перемешивали стеклянной палочкой до тех пор, пока вся соль не перешла в раствор(сначала выпадает осадок светло-голубого цвета).Раствор приобретает темно-синий цвет.
3. К полученному раствору добавили этиловый спирт, объём которого равен 20 мл. Это вызывает выпадение кристаллов комплекса [Cu(NH3)4]SO4·H2O(темно-синего цвета мелкими кристалликами), который в спирте растворим значительно хуже, чем в воде. Стакан с его содержимым поставили на 1 час на баню со снегом для полноты осаждения комплекса.
4. После охлаждения полученное вещество отфильтровали на воронке со стеклянным пористым фильтром (пористость 100), дважды промыли небольшим количеством этилового спирта. Просушили на воронке током воздуха, пока вещество не перестало прилипать к стеклянной палочке, перенесли в чашку Петри и взвесили.
Возможность существования комплекса (расчет констант).
СuSO4+2NH3+2H2O = Cu(OH)2↓+(NH4)2SO4
2NH3+2H2O = 2NH4+
K= 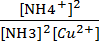 *
*  = 6,48*
= 6,48* 
Cu(OH)2+(NH4)2SO4+2NH3(избыток)=[Cu(NH3)4]SO4 +2H2O
K =  *
*  =
=  = =
= =  = 1,99* 102
= 1,99* 102
Расчет выхода вещества.
1. СuSO4*5H2O+2NH3=Cu(OH)2↓+(NH4)2SO4+3H2O
2. Cu(OH)2+(NH4)2SO4+2NH3(избыток)= [Cu(NH3)4]SO4+2H2O
M(CuSO4*5H2O)=64+32+16*4+10+5*16= 250 г/моль
m(CuSO4*5H2O)=5,001 грамм
n(CuSO4*5H2O) =  = 5,001/250 = 0,02 моль.
= 5,001/250 = 0,02 моль.
M([Cu(NH3)4]SO4*H2O) = 64+4*14+12+32+4*16+2+16 = 246 г/моль.
n([Cu(NH3)4]SO4*H2O) =n(CuSO4*5H2O)= 0,02 моль.
m([Cu(NH3)4]SO4*H2O)теорет. = M(…)* n(…) = 246*0,02 = 4,92 г
mфакт. = 4,6 г
Выход =  * 100% = 93,5%.
* 100% = 93,5%.
Исследование свойств полученного соединения.
При нагревании происходит разложение комплекса:
[Сu(NH3)4]SO4*H2O → CuSO4 + NH3↑ +H2O↑ → СuO↓ + SO3
При температуре ~145°С кристаллы меняют цвет на зеленый, затем при температуре 235°С кристаллы становятся бесформенными, происходит сглаживание углов, кристаллы чернеют.
Пробирочные реакции.
Несколько кристаллов вещества растворили в небольшом количестве воды и разделили раствор на две части.
1. К одной добавили 1-2 мл 5 %-го раствора гидроксида натрия – происходит выпадение осадка голубого цвета и выделение газа:
[Сu(NH3)4]SO4*H2O + 2NaOH = Cu(OH)2↓ + 4NH3↑ + Na2SO4 +H2O
Kl(Cu(OH)2) = 5,6*10-20 𝜷4 = 0,107*1013
K =  *
*  =
=  = 3,4*1040
= 3,4*1040
2. Ко второй части приливаем 1-2 мл 0,5 М раствора сульфида натрия. Выпадают крупинки темного осадка болотного цвета.
[Сu(NH3)4]SO4*H2O+3Na2S+5H2O = CuS↓+(NH4)2SO4+2(NH4)HS+6NaOH
Kl(CuS) = 4*10-38 Kb(NH3) = 0,174*10-4
K =  *
*  =
=  = 2,14*106
= 2,14*106
Данные ИК-спектроскопии.
Для потверждения состава комплекса был снят инфракрасный спект в области 4000-400 см-1.
| Литературные данные | Экспериментальные данные | Отнесение | Примечания |
| 3311,5 | V(NH) V(OH) | ||
| 3255,0 | |||
| 3168,3 | |||
| 2392,0 | Незначительные отклонения | ||
| 2233,4 | Незначительные отклонения | ||
| 2071,4 | Незначительные отклонения | ||
| 1913,8 | Незначительные отклонения | ||
| 1637,2 | Ϭα(NH3);ϭ(H2O) | ||
| 1398,8 | |||
| 1272,5 | Ϭs(NH3) | ||
| 1241,6 | |||
| 1108,8 | ᴠ(SO) | ||
| 728,1 | Pr(NH3) | ||
| 619,3 | Ϭ(OSO) | ||
| 570,9 | Нет литературных данных | ||
| 422,0 | Нет литературных данных |
Выводы.
Результатом данной работы стало получение комплексного соединения [Cu(NH3)4]SO4*H2O. Проведенные качественные реакции, температура разложения, а также данные ИК-спектроскопии подтвердили состав соединения.
Выход составил 93,5% процентов.
|
из
5.00
|
Обсуждение в статье: Синтез сульфата тетрааминмеди (II) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

