 |
Главная |
Управление состоянием равновесия и скоростью сложных процессов
|
из
5.00
|
Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
А) Влияние давления.
Характер влияния давления на равновесие химической реакции определяется знаком разности числа молей газообразных участников реакции или знаком изменения объема. Для газовых реакций, в которых число молей продуктов превышает число молей реагентов увеличение давления неблагоприятно. Смешению равновесия вправо способствует уменьшение давления. Если же реакция протекает с уменьшением числа молей, то повышение давления целесообразно, так как оно сместит равновесия в сторону продуктов реакции.
Б) Влияние концентрации.
В соответсвии с принципом Ле-Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево.
В) Влияние температуры.
Направление смещение равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, обазующихся в данной реакции с поглощением теплоты, то есть усиливает эндотермическое направление реакции. Понижение температуры действует в противоположную сторону, то есть усиливает экзотермическое направление.
Предположим, что в реакторе могут одновременно протекать 2 реакции(параллельные).
a1A+b1B=cC
a2A+b2B=dD
Для расчёта материального баланса равновесной смеси необходимо составить материальный баланс исходной смеси и установить связь между начальными мольными долями компонентов и равновесной степенью превращения ключевого компонента.
a1A+b1B=cC
a2A+b2B=dD
| a1A+b1B=cC a2A+b2B=dD | ∑ | ||||
| Исходные вещества | ZNA | ZNB | |||
| Производи-тельность | -ZNA*X1 -ZNA*X2 | 

| 
|

| 

|
| Конечные вещества | 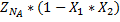
| 

| 
| 
| w |
Примем, что суммарный мольный поток равен единице.
Для упрощения таблица примем,что мольные доли продуктов в исходной смеси равны нулю.

Для расчёта мольных долей компонентов в конечной смеси нужно разделить мольный поток каждого компонента на коэффициент изменения числа молей.
Для расчёта равновесного состава составим систему из двух уравнений:


Для нахождения X1 и X2 надо решить систему трансцендентных уравнений с условием

При любой температуре
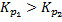

 Для выполнения равенства F1 и F2=0.Необходимо, чтобы концентрация вещества С была больше концентрации компонента D.
Для выполнения равенства F1 и F2=0.Необходимо, чтобы концентрация вещества С была больше концентрации компонента D.




Раздел 2
|
из
5.00
|
Обсуждение в статье: Управление состоянием равновесия и скоростью сложных процессов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

