 |
Главная |
Основное уравнение кинетической теории газов
|
из
5.00
|
I.1 Основы молекулярно-кинетической теории идеальных газов
Основные термодинамические параметры
Состояние некоторой массы газа m определяется тремя
термодинамическими параметрами: р, V, T. Здесь р - давление, V – объем, Т – температура.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и определяющая направление теплообмена между телами. Температура – одно из основных понятий, играющих важную роль не только в термодинамике, но и в физике в целом.
Закон, выражающий зависимость между этими параметрами, называется уравнением состояния
f (р, V, T) = 0.
Дополнительные термодинамические параметры
 – плотность вещества.
– плотность вещества.
 – молярная масса (масса одного моля).
– молярная масса (масса одного моля).
 – число молей.
– число молей.
 – концентрация молекул , где N число всех молекул в объеме V.
– концентрация молекул , где N число всех молекул в объеме V.
 , где
, где  – число Авогадро (число молекул в 1 моле,
– число Авогадро (число молекул в 1 моле,  моль-1).
моль-1).
 – масса одной молекулы любого вещества.
– масса одной молекулы любого вещества.
3 Идеальный газ.
Модель, согласно которой:
а) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
б) между молекулами газа отсутствуют силы взаимодействия;
в) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Термодинамические процессы
Термодинамический процесс- любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров.
Изотермический(закон Бойля-Мариотта)
При T = const; m = const; рV = const.
Для 2-х состояний
р1V1 = р2V2.
Изобарический(закон Гей-Люссака)
При р = const; m = const; V = V0( 1 +  t );
t );
Для 2-х состояний  .
.
Изохорический(закон Шарля)
При V = const; m = const; р = р0( 1 +  t );
t );
Для 2-х состояний  .
.
Уравнение состояния идеального газа
Для данной массы газа (закон. Клапейрона):
 .
.
Для 2-х состояний
 .
.
Для любой массы газа (уравнение Клапейрона-Менделеева):
 или
или  ,
,
где N – число молекул; R = 8,31 Дж/(моль∙К) универсальная газовая постоянная; k = 1,38×10–23 Дж/К – постоянная Больцмана; R =kNаоткуда следует
 ,
,
где n0 – концентрация молекул.
Закон Авогадро
Моли любых газов при одинаковой температуре и давлении занимают одинаковые объемы.
Нормальные условия
(р0 = 1,01×105 Па, T = 273,15 К);  = 22,41∙10–3 м3/моль.
= 22,41∙10–3 м3/моль.
Давление смеси газов (закон Дальтона)
 ,
,
где  – парциальное давление i-го газа,
– парциальное давление i-го газа,
 – число газов в смеси.
– число газов в смеси.
Парциальное давление-давление, которое оказывали бы газы смеси, если бы они занимали объем, равный объему смеси при той же температуре.
Масса 1 моля смеси газов

где mi – масса i-го газа, входящего в смесь;
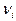 – число молей i-го газа, находящегося в смеси.
– число молей i-го газа, находящегося в смеси.
Основное уравнение кинетической теории газов
 или
или  ,
,
где  – среднеквадратичная скорость молекул;
– среднеквадратичная скорость молекул;  – средняя кинетическая энергия поступательного движения одной молекулы.
– средняя кинетическая энергия поступательного движения одной молекулы.
|
из
5.00
|
Обсуждение в статье: Основное уравнение кинетической теории газов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

