 |
Главная |
Нитротолуолы (смесь изомеров)
|
из
5.00
|

Приготовление нитрующей смеси.В колбу вносят 18,2 мл концентрированной азотной кислоты плотностью 1,4 г/см (0,27 моль HNO3)* и постепенно небольшими порциями при перемешивании приливают 22 мл концентрированной серной кислоты. Полученную смесь охлаждают до комнатной температуры.
Получение нитротолуолов.В трехгорлую колбу (2) (рис. 16), снабженную обратным воздушным холодильником (4) и термометром (5), помещают 27 мл толуола. В самом начале нитрования водяная баня (1), изображенная на рис. 16, не используется. Открыв пробку, приливают в колбу через горло (3) около 5 мл нитрующей смеси. Плотно закрывают пробку и вручную энергично встряхивают содержимое колбы, однако так, чтобы реакционная масса как можно меньше попадала изнутри на резиновые пробки. Повторяют несколько раз операцию добавления нитрующей смеси и энергичного встряхивания, постоянно наблюдая за показаниями термометра. Если термометр показывает температуру выше 60 °С, то колбу охлаждают до этой температуры (но не ниже) в бане с водой. После прибавления всей нитрующей смеси колбу нагревают при 60 °С в течение 30 мин, периодически встряхивая. Определяют конец реакции по пробе реакционной смеси: капля органического слоя должна тонуть в воде. Реакционную смесь переносят в делительную воронку. Дают жидкостям расслоиться и отделяют нижний слой отработанных кислот. Затем органический слой промывают последовательно водой, разбавленным (~10 %) раствором соды и снова водой. После последней промывки и отстаивания нижний слой сливают в сухую колбу, как можно тщательнее отделяя его от воды. К органической жидкости прибавляют прокаленный хлористый кальций в таком количестве, чтобы он смог поглотить всю прошедшую вместе с органическим слоем воду, но при этом оставался твердым. Для ускорения обезвоживания смесь нитротолуолов с хлористым кальцием полезно погреть на бане при встряхивании. Обезвоживание жидкости продолжают до тех пор, пока она станет прозрачной.
 Рис. 16.Схема установки для нитрования толуола: 1 – баня, 2 – реакционная колба, 3 – горло, через которое прибавляется нитрующая смесь, 4 – воздушный обратный холодильник, 5 – термометр
Рис. 16.Схема установки для нитрования толуола: 1 – баня, 2 – реакционная колба, 3 – горло, через которое прибавляется нитрующая смесь, 4 – воздушный обратный холодильник, 5 – термометр
|
Собирают установку для простой перегонки с водяным холодильником и термометром до 250 °С (рис. 17). Фильтруют жидкость от хлористого кальция через складчатый фильтр в перегонную колбу.
Нагревая колбу на сетке, начинают разгонку жидкостей. До температуры паров 150 °С через рубашку холодильника пропускают слабый ток воды, после достижения 150 °С воду можно выключить. Вначале собирают фракцию, перегоняющуюся до 200 °С. Она состоит главным образом из непрореагировавшего толуола. Отогнанный толуол сливают в склянку для отходов растворителей. После отгонки толуола в качестве приемника для второй основной фракции подставляют сухую взвешенную колбу. Температура паров быстро поднимается от 200 до 220 °С, при которой обычно начинает отгоняться основная масса смеси изомерных нитротолуолов. По мере перегонки температура кипения по степенно повышается. Перегонку ведут до температуры паров 237 °С. Нельзя отгонять жидкость из колбы досуха. После окончания перегонки приемник с нитротолуолами взвешивают. Выход 75 %.

Рис. 17. Установка для простой перегонки: 1 – колба Вюрца, 2 – термометр, 3 – прямой водяной холодильник, 4 – алонж, 5 – приемник
Хроматографическое определение изомерного
состава нитротолуолов
Для определения изомерного состава продуктов нитрования толуола используют метод газо-жидкостной хроматографии. Смесь нитротолуолов, полученную в результате перегонки, растворяют в четыреххлористом углероде. Небольшую пробу раствора (до 1 микролитра, 1 микролитр = 0,001 мл) с помощью микрошприца вводят в испаритель хроматографа, откуда она с током газа-носителя (гелия) попадает в колонку прибора, где происходит разделение смеси на составляющие ее компоненты. Результат разделения автоматически записывается на хроматограмме, вид которой изображен на рис. 18.
Площадь на хроматограмме, ограниченная кривой пика, соответствующего определенному изомеру(Sx), при прочих равных условиях пропорциональна его содержанию сx в пробе: Sx = fx сx. Коэффициент про порциональности fx в общем случае зависит от природы вещества, но для изомеров он одинаков. Исходя из этого, можно рассчи-

Рис. 18. Хроматограмма смеси изомерных нитротолуолов, содержащей следы непрореагировавшего толуола: а) расположение пиков компонентов на диаграммной бумаге, б) та же хроматограмма, представленная в виде зависимости величины электрического сигнала от времени прохождения пробы по колонке
| тать процентное содержание, например о-изомера в смеси по формуле: рорто = 100·Sорто/(Sорто + Sмета + Sпара). Здесь Sорто, Sмета и Sпара – площади пиков на хроматограмме, соответствующих орто-, мета- и пара-нитротолуолам. На рис. 19 иллюстрирует простой способ определения площади хроматографического пика (S) путем измерения его высоты (h) и полуширины (b – ширина пика на половине его высоты: S = b·h |  Рис. 19. Определение площади хроматографического пика
Рис. 19. Определение площади хроматографического пика
|
Пояснения к синтезу
Реакция нитрования ароматических углеводородов происходит на границе раздела между двумя несмешивающимися жидкостями (углеводород – нитрующая смесь). Поэтому при проведении синтеза требуется энергичное перемешивание. Нитрование – экзотермическая реакция, сопровождающаяся выделением большого количества тепла (DН = -120 кДж/моль). Повышение температуры ускоряет такие нежелательные процессы, как образование полинитросоединений и окисление органических веществ азотной кислотой. Для поддержания оптимальной температуры вначале реакционную смесь необходимо эффективно охлаждать. По мере расходования реагентов и снижения их концентраций скорость нитрования уменьшается, а следовательно, уменьшается и количество тепла, выделяющееся в единицу времени. В этом случае теплоты реакции уже становится недостаточно для поддержания оптимальной температуры, поэтому для завершения реакции смесь приходится нагревать.
Плотность нитротолуолов больше единицы, а толуола – меньше единицы. Смесь, в которой преобладают нитротолуолы, имеет плотность больше единицы, поэтому, чтобы убедиться в степени завершенности реакции нитрования, необходимо извлечь из колбы каплю органического слоя и поместить ее в пробирку с водой. Если капля тонет в воде, она состоит в основном из нитротолуолов. В противном случае нагревание реакционной смеси следует продолжать.
Этот способ определения конца реакции очень приблизителен. Более совершенным методом является определение в органическом слое относительного содержания толуола и нитротолуолов с помощью газо-жидкостной хроматографии.
Плотность смеси нитротолуолов ниже плотности отработанной нитрующей смеси, т.е. смеси азотной и серной кислот в конце реакции, поэтому при разделении в делительной воронке органический слой располагается над кислотным.
При последующих промывках водой и водным раствором соды слой, содержащий нитросоединения, находится внизу.
Побочными продуктами в реакции нитрования кроме динитросоединений являются полинитрофенолы. Гидроксигруппа у бензольного кольца образуется в результате нуклеофильного замещения водорода в 5 положении 2,4-динитротолуола на группу -О-NО2 и последующего гидролиза соответствующего эфира азотной кислоты. Образовавшийся фенол тут же нитруется с образованием тринитропроизводного.
При нитровании толуола побочным продуктом является тринитро-м-крезол (1-гидрокси-3-метил-2,4,6-тринитробензол). Присутствие полинитрофенолов обнаруживается при промывке органического слоя раствором соды. В щелочной среде слабо-желтая окраска раствора полинитрофенолов усиливается, переходя в оранжевую, в результате образования нитрофенолятов. Интенсивный красно-оранжевый цвет содового раствора при промывке нитротолуолов в делительной воронке свидетельствует о большом содержании тринитро-м-крезола в реакционной смеси, что бывает при ее перегреве. Промывка продукта водным раствором соды служит, таким образом, для удаления из него примесей как неорганических кислот, так и тринитро-м-крезола.
Компоненты органического слоя: непрореагировавший толуол, смесь изомерных нитротолуолов и динитротолуолы разделяют путем простой перегонки. В данном случае это возможно, так как они имеют сильно различающиеся температуры кипения (60 – 100 °С). Однако следует иметь в виду, что даже в этой благоприятной ситуации достичь полного разделения компонентов невозможно. Хроматограмма смеси нитротолуолов, выделенных с помощью перегонки, показывает, что в ней присутствует некоторое количество толуола (Ткип 111° С), хотя фракция нитротолуолов была отобрана в интервале 220 – 238° С. Из сказанного ясно, что с помощью простой перегонки разделить изомерные нитротолуолы, разность температур кипения которых составляет 18 °С, невозможно. Для разделения смесей веществ, имеющих близкие температуры кипения, применяются ректификационные колонки.
Контрольные вопросы
1. Почему при проведении нитрования ароматических углеводородов необходимо энергичное перемешивание реакционной смеси?
2. Какова роль серной кислоты в нитрующей смеси?
3. Почему при нитровании толуола преимущественно образуются орто- и пара-нитротолуолы, а мета-изомера образуется мало? Дайте объяснение с точки зрения легкости образования соответствующих s-комплексов.
4. Как можно определить конец реакции нитрования?
5. Какой состав имеет реакционная смесь в конце реакции? Какие побочные продукты образуются при нитровании толуола до мононитросоединения?
6. Как будет зависеть относительное количество 2,4-динитротолуола в реакционной смеси от таких факторов, как:
а) порядок смешения реагентов (I – нитрующую смесь медленно приливают к толуолу; II – толуол медленно приливают к нитрующей смеси)?
б) температура реакционной смеси?
в) интенсивность перемешивания?
7. Почему в 2,4-динитротолуоле нуклеофильному замещению на группу -О-NО2 подвергается водород преимущественно в положении 5?
8. При нитровании толуола при 60 °С тринитротолуол практически не образуется, однако в смеси всегда присутствует небольшое количество тринитро-м-крезола. Как это можно объяснить?
9. Как выделяют нитротолуолы из их смеси с другими органическими соединениями, присутствующими в реакционной массе?
10. Используя данные о свойствах изомерных нитротолуолов, предложите способ выделения п-нитротолуола из их смеси.
11. Какие меры безопасности необходимо соблюдать в процессе получения нитротолуолов?
2.2.3. м-Динитробензол

В вытяжном шкафу собирают установку, состоящую из колбы на 100 мл (желательно с широким горлом) и термометра, укрепленного таким образом, чтобы его шарик был приближен ко дну колбы, но не касался его (рис. 20). Должна быть предусмотрена возможность нагревания колбы на сетке.
| Смешивают в колбе 8,3 мл нитробензола с 25 мл концентрированной серной кислоты (d = 1,84 г/см3) и нагревают до 80 – 90 °С. Горелку выключают и небольшими порциями прибавляют 12,5 г тонко растертого нитрата натрия, следя за тем, чтобы температура не поднималась выше 130 °С. Содержимое колбы постоянно перемешивают, покачивая установку вместе со штативом, на котором укреплена колба. Не должно наблюдаться сильного выделения оксидов азота. Образующийся по реакции м-динитробензол всплывает в виде маслянистого слоя. После добавки всего нитрата |  Рис. 20. Схема установки для синтеза м-динитробензола
Рис. 20. Схема установки для синтеза м-динитробензола
|
 Рис. 19. Схема установки для синтеза м-динитробензола
Рис. 19. Схема установки для синтеза м-динитробензола
|
включают горелку и продолжают нагревание при 130 °С еще 30 минут. Затем содержимому колбы дают охладиться до 70 °С и при энергичном перемешивании выливают в стакан, в котором находится приблизительно 100 г измельченого льда. м-Динитробензол выделяется в виде желтого осадка. Его отфильтровывают на воронке Бюхнера, промывают на фильтре водой, затем слабым (~10 %) раствором соды и снова водой до нейтральной реакции промывных вод. Хорошо отжимают кристаллы и сушат на воздухе. Полученный продукт взвешивают и определяют его температуру плавления.
Для очистки от примесей м-динитробензол перекристаллизовывают из небольшого количества спирта. Для этого неочищенный м-динитробензол помещают в колбу с обратным холодильником и прибавляют к нему 10 мл изопропилового спирта. Далее необходимый объем растворителя подбирают опытным путем, и наблюдая за растворением вещества при кипячении растворителя. Нагревают колбу на водяной бане и при необходимости, если нет полного растворения, прибавляют небольшими порциями изопропиловый спирт через верх холодильника. После полного растворения осадка к прозрачному горячему раствору через верх холодильника прибавляют по каплям воду до помутнения раствора. Добавляют в колбу несколько капель спирта до исчезновения мути и затем горячий однородный раствор, выключив предварительно горелку, переливают в сухой стаканчик. Дают раствору постепенно охладиться при размешивании его стеклянной палочкой. Выпавший м-динитробензол отфильтровывают на воронке Бюхнера, сушат до постоянного веса на воздухе, определяют массу и температуру плавления продукта.
Выход 70 %. Тпл 90 °С.
Пояснения к синтезу
Нитробензол из-за электроноакцепторного влияния группы NO2 нитруется в значительно более жестких условиях, чем бензол. Понятие “более жесткие условия” означает, что необходимо брать более концентрированные кислоты и поддерживать более высокую температуру реакции. Меньшее содержание воды приводит к более высокой кислотности реакционной смеси и, следовательно, к большей концентрации нитроний-катиона (NО2+). Для получения м-динитробензола можно использовать “дымящую” азотную кислоту с плотностью 1,5 г/мл (примерно 98 % НNО3). Однако более удобным лабораторным способом синтеза является нитрование нитробензола, растворенного в концентрированной Н2SО4, путем прибавления к нагретому раствору размельченной натриевой или калиевой соли азотной кислоты. Азотная кислота образуется непосредственно в реакционном сосуде по реакции:
NaNO3 + H2SO4 = NaHSO4 + HNO3
Нитрование проходит практически в безводной среде. Серная кислота в данном случае выполняет функции: 1) реагента для образования НNО3 из NаNО3, 2) кислотного катализатора, который способствует образованию NО2+, 3) растворителя. Преимущество такого способа – протекание реакции в гомогенной среде, т.к. и нитробензол, и нитрат натрия растворимы в 95 % Н2SО4, а это обеспечивает большую скорость процесса по сравнению с гетерогенными условиями. Недостаток способа – большой расход серной кислоты.
Особое внимание необходимо обращать на соблюдение указанного в прописи температурного режима: при добавлении нитрата натрия температура реакционной смеси ни в коем случае не должна превышать 130 °C. При повышенной температуре усиливается окислительное действие азотной кислоты, в результате чего образуются полинитрофенолы и продукты более глубокого окисления органического вещества (смола). Тринитробензол практически не образуется.
Процессам окисления способствует ускоряющаяся при повышенной температуре реакция разложения азотной кислоты на воду, кислород и диоксид азота. Присутствие примеси полинитрофенолов обнаруживается при обработке расплавленного неочищенного м-динитробензола щелочью или содой: в результате образования окрашенных полинитрофенолятов промывная жидкость окрашивается в оранжевый цвет.
м-Динитробензол значительно хуже растворим в концентрированной серной кислоте, чем исходный нитробензол, поэтому по мере образования он выделяется в горячей реакционной смеси в виде маслянистого слоя. При охлаждении смеси, а также при выливании ее в размельченный лед м-динитробензол затвердевает. Для отмывания осадка от кислот, захваченных при отверждении, его промывают последовательно водой, раствором соды и вновь водой.
Контрольные вопросы
1. Почему синтез динитробензола приходится проводить в более жестких условиях, чем нитробензола?
2. Почему при нитровании нитробензола образуется преимущественно мета-изомер, а орто- и пара-изомеров образуется очень мало? Дайте объяснение с учетом различной легкости образования соответствующих s-комплексов.
3. Напишите уравнение равновесной реакции образования нитроний-катиона в смеси концентрированных азотной и серной кислот. Почему попадание воды в реакционную смесь, так же как и образование ее в ходе реакции, уменьшают концентрацию NO2Å?
4. Сравните используемое в синтезе количество серной кислоты с теоретически необходимым по уравнению основной реакции. Почему в описанном синтезе м-динитробензола применяется значительный избыток серной кислоты?
5. Рассчитайте концентрацию серной кислоты в конце реакции. Почему реакционную массу после завершения реакции и охлаждения до 70 °С рекомендуется выливать не в воду, а на размельченный лед?
6. Напишите реакцию термического разложения азотной кислоты. Какой нежелательный процесс усиливается при этом?
7. Основной примесью в неочищенном м-динитробензоле является непрореагировавший нитробензол. Найдите в справочнике [2] данные о растворимости этих двух веществ в этиловом спирте и на основании этих данных сделайте вывод об эффективности перекристаллизации из спирта м-динитробензола для его очистки.
8. Какие правила безопасности следует соблюдать при выполнении синтеза м-динитробензола?
Cульфаниловая кислота

Работа выполняется под тягой. Для синтеза применяется прибор, используемый при получении м-динитробензола (рис. 20 на стр. 95).
В колбу помещают 15 мл свежеперегнанного анилина и к нему небольшими порциями, чтобы смесь не перегревалась, добавляют 27 мл концентрированной серной кислоты (d = 1,84 г/см3). Раствор нагревают на сетке при 180 – 190 °C до тех пор, пока проба, растворенная в горячем водном растворе щелочи, не перестанет выделять анилин (масляные капельки). Сульфирование идет 1,5 – 2 часа. Перегревание реакционной смеси выше 190 °С ведет к ее обугливанию.
По окончании сульфирования охлажденную до 80 – 90 °С реакционную массу выливают при размешивании в 200 мл холодной воды. При охлаждении сульфаниловая кислота выпадает в осадок. Кислоту отфильтровывают на воронке Бюхнера, дважды промывают небольшими порциями холодной воды и перекристаллизовывают из воды с добавлением активированного угля. Способ перекристаллизации описан в работе по получению ацетанилида (стр. 64). Выход дигидрата сульфаниловой кислоты п-H2N-C6H4-SO3H.2H2O 15 – 17 граммов.
Пояснения к синтезу
Реакции электрофильного замещения водорода в кольце ароматических аминов имеют ряд особенностей, обусловленных наличием у атома азота неподеленной электронной пары. С кислотами, которые используются в качестве электрофильных реагентов, амины реагируют, прежде всего, как основания с образованием солей:

| (1) |
Из двух форм - свободного амина I и его соли II - первая содержит сильный электронодонорный заместитель -NH2, а вторая – сильнейший электроноакцептор - группу -NH3+.
Электрофильное замещение в солях типа II происходит значительно медленнее, чем в молекулах свободных аминов I. Ориентирующее действие амино- и аммонийной группы также различно: группа NH2 – сильный орто-пара-ориентант, а группа -NH3+ направляет электрофильные частицы в мета-положение.
В сильнокислой среде (в концентрированных кислотах: серной, соляной и т.п.) равновесие (1) почти полностью сдвинуто вправо при условии, что ароматическое ядро не содержит сильных электроно-акцепторных заместителей R. Из-за дезактивирующего влияния группы -NH3+ сульфирование анилина до сульфаниловой кислоты при комнатной температуре не происходит. Для сравнения можно указать на то, что при действии концентрированной серной кислоты на фенол последний легко превращается в смесь орто-, пара-сульфокислот и 2,4-дисульфокислоты фенола.
Следует, однако, отметить, что даже в сильнокислых растворах очень активные электрофильные реагенты и окислители способны взаимодействовать со свободным амином, присутствующим в этих условиях в ничтожной концентрации. Например, концентрированная азотная кислота энергично окисляет анилин (в форме I) и в то же время реагирует с его солью (форма II), образуя некоторое количество мета-нитроанилина. При действии концентрированной азотной кислоты на анилин образуется много продуктов осмоления и следы мета-нитроанилина. Для получения из анилина п-нитроанилина, п-броманилина и т.п. приходится прибегать к методу “защиты” аминогруппы, а точнее к ее временной дезактивации путем ацилирования.
Например, п-нитроанилин получают следующим образом:

| (2) |

| (3) |

| (4) |
Превращения анилина в сульфаниловую кислоту включают в себя стадии (5 – 7), аналогичные превращениям (2 – 4) с тем отличием, что в случае сульфирования анилина все последовательные реакции проходят в одном сосуде и промежуточные вещества не выделяются.

| (5) |
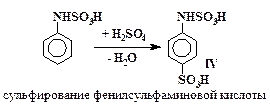
| (6) |

| (7) |
Большинство сульфокислот очень хорошо растворяется в воде. В отличие от них сульфаниловая кислота, как и другие ароматические аминосульфокислоты, сравнительно малорастворима: в 100 мл воды при 20° С может раствориться только около 1 г кислоты. Аминосульфокислоты в кристаллическом состоянии существуют в форме биполярных ионов, которые также называют внутренними солями или цвиттер-ионами. Образование биполярного иона происходит в результате внутримолекулярного взаимодействия аминогруппы, обладающей слабо-основными свойствами, с сульфогруппой, кислотные свойства которой по силе сопоставимы с серной кислотой:

Органические соединения, образующие биполярные ионы, имеют очень прочные ионные кристаллические решетки. Энергии, выделяющейся при гидратации частиц VI, недостаточно для компенсации энергетических затрат, необходимых для разрушения кристаллической решетки сульфаниловой кислоты. Это и является причиной малой растворимости сульфаниловой кислоты в воде.
Контрольные вопросы
1. Напишите уравнения всех промежуточных стадий при превращении анилина в сульфаниловую кислоту. Почему в отличие от фенола анилин при действии серной кислоты не образует сульфокислот при комнатной температуре?
2. Напишите уравнение реакции, на которой основано определение конца процесса превращения анилина в сульфаниловую кислоту.
3. Почему в отличие от большинства других сульфокислот (например, п-толуолсульфокислоты) сульфаниловая кислота малорастворима в воде?
4. Почему малорастворимая в воде сульфаниловая кислота хорошо растворяется в водной щелочи?
5. Какие меры предосторожности надо предпринимать в процессе синтеза сульфаниловой кислоты?
|
из
5.00
|
Обсуждение в статье: Нитротолуолы (смесь изомеров) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

