 |
Главная |
Основные теоретические положения. Электроотрицательные группы, присоединенные к углероду
|
из
5.00
|
Электроотрицательные группы, присоединенные к углероду, способны в определенных условиях замещаться на другие атомы и группы. В общем виде такие процессы могут быть представлены схемами (1, 2). На первой показан процесс замещения у sp3-гибридизованного (насыщенного) атома углерода:

| (1) |
на второй – у карбонильного sp2-гибридизованного:

| (2) |
Уходящие группы X уносят с собой электронную пару, с помощью которой они были связаны с углеродом, поэтому они отщепляются, как правило, в виде анионов. Однако если в субстрате группа X была заряжена положительно (например, в протонированном спирте Н2ОÅ–R), то она отщепляется в виде нейтральной молекулы (H2O).
Частицы, обладающие подвижной парой электронов и способные атаковать положительно заряженный атом углерода, замещая находящиеся у него электроотрицательные группы X, называются нуклеофилами.
Нуклеофильная частица Y обязательно должна иметь подвижную, обычно неподеленную, электронную пару, которая необходима для образования новой ковалентной связи C-Y.
Реакции нуклеофильного замещения обозначаются символами SN (от английского nucleophilic substitution).
Нуклеофилами являются: Н2О:, НО:─, RÖH, RO:─, RCOO:─, H2S:, HS:─, :SHR, :NH3, :NH2R, :NHR2, F:─, Cl:─, Br:─, I:─, :CN─, :NO2─ и т. д.
Как следует из приведенного списка, нуклеофилы часто (хотя и не всегда) являются отрицательно заряженными частицами. Все нуклеофилы – основания, однако нуклеофильность частицы и ее основность – не одно и то же. Под нуклеофильностью понимается способность взаимодействовать с положительно заряженным атомом углерода, а под основностью – с протоном. Поэтому увеличение нуклеофильности далеко не всегда сопровождается ростом основности. Так, бромид-анион Br─ по своему нуклеофильному действию почти равноценен OH─, но является по сравнению с ним несравнимо более слабым основанием.
Нуклеофильное замещение у sp3-гибридизованного атома углерода
В качестве уходящих групп в процессах, проходящих по схеме (1), чаще всего выступают галогены, фрагменты кислот
(-OSO3H, ‑ONO2), гидроксильная группа. Галогены по легкости замещения можно расположить в ряд:I > Br > Cl > > F.
В общем случае уходящая группа X замещается тем труднее, чем слабее выражены кислотные свойства HX. В случае спиртов (X = OH) гидроксид-анион – плохая уходящая группа, так как его сопряженной кислотой является вода H-OH – очень слабая кислота. Для осуществления нуклеофильного замещения спиртовой ОН-группы реакцию проводят в среде сильной кислоты (чаще всего – серной). В этих условиях гидроксильная группа спирта протонируется и превращается в хорошую уходящую группу Н2О+ – (H3O+ – сильная кислота):
ROH + H2SO4  ROH2+ + HSO4- (3)
ROH2+ + HSO4- (3)
Спирты с серной кислотой образуют также сложные эфиры (алкилсерные кислоты):
 (4)
(4)
| алкилсерные кислоты |
Можно видеть, что как в стадии (3), так и в стадии (4) образуются соединения с хорошими уходящими группами. Они и участвуют в дальнейших реакциях нуклеофильного замещения:
ROH2+ + Br-  RBr + H2O
RBr + H2O
ROSO3H + Br-  RBr + HSO4-
RBr + HSO4-
Механизмы реакций нуклеофильного замещения разнообразны. При замещении у sp3-гибридизованного атома углерода наиболее характерны мономолекулярный SN1:

и бимолекулярный SN2 механизмы:

Цифры 1 и 2 в этих символах обозначают число частиц, взаимодействие которых приводит к переходному состоянию (состояние с максимальной величиной потенциальной энергии системы). Если процесс состоит из нескольких последовательных элементарных стадий, то молекулярность определяется самой медленной реакцией.
Можно видеть, что процесс SN1 включает две элементарные реакции, причем медленная стадия представляет собой мономолекулярный разрыв связи С-Х. Переходное состояние SN2-типа достигается при столкновении двух частиц (Y- и R3CX) , следовательно, этот процесс бимолекулярный.
Скорости реакций, проходящих по SN1-механизму, зависят только от концентрации соединения RX:
v = k.cRX
(v – скорость реакции, k – константа скорости, cRX– концентрация субстрата), в то время как скорости SN2-процессов увеличиваются прямо пропорционально концентрациям и субстрата, и нуклеофильного реагента (сY):
v = k.cRX.сY
Молекулярность процессов нуклеофильного замещения (SN1 или SN2) зависит от многих факторов: природы субстрата, растворителя, активности нуклеофила.
Субстраты, способные образовывать относительно устойчивые карбокатионы в полярных растворителях (вода, серная кислота, муравьиная кислота и т. п.), реагируют по SN1-механизму. К ним относятся соединения, в которых уходящие группы находятся у третичных углеродных атомов или у атомов в аллильном или бензильном положениях. Ниже представлено несколько примеров таких соединений:

| СН2=СН-СН2-Cl | 
|
| трет-бутилхлорид, | хлористый аллил, | хлористый бензил. |
В первичных галогеналканах (например, в CH3CH2CH2Cl) замещение преимущественно проходит по механизму SN2.
Вторичные алкилгалогениды типа бромистого изопропила CH3CH(Br)CH3 реагируют одновременно по обоим механизмам, часть молекул – по SN1-, а часть – по SN2- механизму.
Ускорение нуклеофильного замещения OH-группы в спиртах в присутствии сильных кислот обусловлено кислотным катализом. Реакции нуклеофильного замещения, катализируемые кислотами, также могут протекать по мономолекулярному и бимолекулярному механизмам. Мономолекулярный описывается схемой:



Последовательность элементарных реакций бимолекулярного замещения спиртовой гидроксильной группы имеет вид:

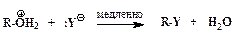
Реакции нуклеофильного замещения спиртов обратимы. Для того чтобы сместить равновесие в сторону алкилгалогенида в качестве реагента применяют газообразные галогеноводороды, либо реакцию проводят в среде серной кислоты, связывающей воду, например:
С2H5OH + HCl(газ)  С2H5Cl + H2O
С2H5Cl + H2O
Нуклеофильное замещение у sp2-гибридизованного
карбонильного углерода
Этот вид замещения имеет место при взаимодействиях:
а) карбоновых кислот со спиртами (реакции этерификации),
б) практически всех функциональных производных карбоновых кислот – сложных эфиров, ангидридов, галогенангидридов, амидов и т.п. – с водой (реакции гидролиза производных карбоновых кислот),
в) галогенангидридов и ангидридов карбоновых кислот с аммиаком, фенолами, и т. п. (реакции ацилирования соответствующих классов соединений).
Все эти взаимодействия в общем виде описываются схемой (2). Например, уравнение ацилирования анилина с помощью уксусного ангидрида (см. основную реакцию синтеза ацетанилида по методу А, стр. 63) получается из схемы (2) при R = CH3, X = OCOCH3, Y = C6H5NH2.
Реакционная способность перечисленных соединений чрезвычайно сильно зависит от природы заместителя Х: чем выше электронодонорные свойства Х, тем ниже положительный заряд на карбонильном атоме углерода и тем медленнее протекает реакция. Например, хлорангидрид уксусной кислоты СН3СО-Cl с водой реагирует едва ли не со взрывом, тогда как диметилацетамид СН3CO-N(CH3)2 медленно гидролизуется лишь при кипячении с водными растворами кислот (серной, соляной и т.п.).
Карбоновые кислоты (RCO-OH), их сложные эфиры (RCO-OR¢) и амиды кислот (RCO-NH2, RCO-NHR¢, RCO-NHR¢2) характеризуются относительно низкой реакционной способностью, так как группы -OH, -OR, -NH2, -NHR и -NR2 сопряжены с соседней двойной связью С=О и проявляют электронодонорные свойства. Поэтому для этих соединений процессы нуклеофильного замещения у sp2-гибридизованного атома углерода осуществляют каталитически при содействии сильных кислот.
Роль кислоты и в этом случае заключается в протонировании карбонильного атома кислорода, имеющего следствием рост положительного заряда на соседнем углеродном атоме:

Далее происходит присоединение нуклеофила к карбонильному атому углерода с образованием промежуточного продукта (интермедиата):

интермедиат
Это лимитирующая, самая медленная стадия процесса. Таким образом, реакция замещения в целом классифицируется как бимолекулярная. Атакуемый атом углерода в процессе образования интермедиата изменяет свое валентное состояние от sp2- до sp3-, следовательно углы между s-связями, которые образует этот атом, уменьшаются от 120° до ~109° (заместителям вокруг этого атома становится “теснее”). Поэтому на скорость процессов нуклеофильного замещения у sp2-гибридизованного атома углерода значительное влияние оказывают величины объемов групп R, X и Y. Чем они больше, тем медленнее при прочих равных условиях лимитирующая стадия образования интермедиата и, следовательно, медленнее проходит весь процесс замещения.
Интермедиат неустойчив и быстро отщепляет либо HX, превращаясь таким образом в продукт замещения, либо HY, что возвращает его в начальное состояние.

Процесс завершается отщеплением Н+ от карбонильной группы:
Реакции нуклеофильного замещения у карбонильного атома, катализируемые сильными кислотами, обратимы. Важно отметить, что прямая и обратная реакции имеют одни и те же промежуточные соединения. Этот частный пример иллюстрирует общий для всех обратимых реакций принцип микроскопической обратимостихимических процессов. Ниже приведен пример, конкретизирующий данную схему и показывающий единый механизм обратимого процесса этерификации и гидролиза сложного эфира.



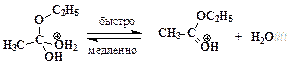

Гидролиз производных карбоновых кислот (сложных эфиров, амидов, ангидридов, галогенангидридов) проходит не только в кислой, но также и в щелочной среде при участии гидроксид-анионов. Естественно, карбоновые кислоты в щелочной среде образуются в виде карбоксилат-ионов RCOO-, которые превращают в недиссоциированную форму RCOOH действием сильных кислот. Примером щелочного гидролиза производных карбоновых кислот может служить реакция расщепления ацетанилида:

| ацетанилид или фениламид уксусной кислоты | ацетат натрия | анилин |
Механизм щелочного гидролиза функциональных производных карбоновых кислот показан на следующей схеме:


Две первые реакции равновесны, однако третья в условиях избытка щелочи оказывается практически необратимой. Причиной этого является высокая устойчивость карбоксилатного иона, обусловленная делокализацией отрицательного заряда, в равной мере принадлежащего обоим атомам кислорода.
Более подробные сведения об особенностях протекания и механизмах нуклеофильных реакций замещения представлены в учебниках по органической химии, например, в [9].
Контрольные вопросы
1. Какие реагенты называются нуклеофильными? Приведите типичные примеры нуклеофильных реагентов.
2. Напишите уравнения типичных реакций нуклеофильного замещения алкилгалогенидов.
3. Изобразите схемы реакций нуклеофильного замещения алкилгалогенидов SN1- и SN2-типа.
4. В чем особенность реакций нуклеофильного замещения спиртов? Покажите механизм реакции превращения 1-пропанола в 1-бромпропан.
5. Напишите уравнения реакций, иллюстрирующих механизм образования трет-бутилхлорида из трет-бутанола.
6. Какие производные карбоновых кислот вступают в реакции нуклеофильного замещения? Какое влияние оказывает природа заместителей на реакционную способность функциональных производных карбоновых кислот?
7. На примере хлористого бензоила С6Н5СОCl покажите основные типы нуклеофильных реакций замещения.
8. Изобразите механизм щелочного гидролиза бутилового эфира уксусной кислоты (бутилацетата) СН3СООС4Н9.
9. Изобразите механизм кислотного гидролиза N,N-диметилформамида.
Бромистый изопропил

Собирают установку, изображенную на рис. 10. В приемник наливают столько воды, чтобы конец алонжа касался ее поверхности. В колбу, которая будет служить реакционным сосудом, наливают 18 мл свежеперегнанного изопропилового спирта (см. примечание 1), 12 мл воды, а затем осторожно при размешивании и охлаждении 5 мл концентрированной серной кислоты.
Смесь охлаждают до 10 – 15 °С холодной водой и при перемешивании добавляют 17 г бромистого калия, тонко измельченного в ступке. Реакционную смесь нагревают на сетке. Пары бромистого изопропила вместе с некоторым количеством спирта, воды и диизопропилового эфира, образующегося в качестве побочного продукта, проходят через дефлегматор и конденсируются в холодильнике. При слишком энергичном нагревании в приемник может перейти также и часть НВr. Бромистый изопропил летуч, поэтому его собирают под слоем воды в сосуде, частично заполненном водой.
Нагрев смеси продолжают до тех пор, пока в приемник не перестанут поступать маслянистые капли, опускающиеся на дно. Температура паров на выходе из дефлегматора в конце реакции достигает 90 – 95 °С.

Рис. 9. Установка для получения бромистого изопропила
Содержимое приемника переносят в делительную воронку и как можно тщательнее отделяют нижний слой от воды, собирая его в сухую колбочку или стаканчик (см. примечание 2). Для удаления небольшого остатка воды, захваченного органическим слоем, его “осушают” с помощью безводного хлористого кальция. Через 20 – 30 мин после внесения безводного СаСl2 жидкость над ним становится прозрачной, что указывает на почти полное связывание воды.
Для перегонки бромистого изопропила используют ту же установку, в которой проводили синтез. Колбу, дефлегматор и приемник перед перегонкой высушивают. Приемник взвешивают. Отделяют бромистый изопропил от твердого осадка СаCl2 декантацией (сливанием через край) в перегонную колбу. Медленно перегоняют бромистый изопропил, отбирая фракцию с температурой кипения до 60 °С. Снова взвешивают приемник и по разности весов определяют массу полученного продукта. Измеряют его показатель преломления. Для чистого бромистого изопропила nD20 = 1,4251, Ткип = 59 °С. Выход – 80 %.
Примечания:
1. Если использовать не свежеперегнанный изопропиловый спирт, то в ряде случаев реакционная смесь при нагревании начинает сильно пениться.
Изопропиловый спирт можно перегнать, используя установку, предназначенную для синтеза (рис. 10), только перегонную колбу следует нагревать не на сетке, а на водяной бане. Для перегонки следует взять 25 мл спирта. Первые 2 мл погона собирают в отдельный сосуд. Фракцию, перегоняющуюся при 80 – 81 °C, далее используют для проведения реакции. В перегонной колбе должно остаться 1 – 2 мл жидкости. Остаток соединяют с первой фракцией и сливают в специально предназначенный для этой цели сосуд. Если эту же колбу, из которой перегоняли спирт, предполагается использовать в качестве реакционного сосуда, то после проведения перегонки ее следует ополоснуть водой.
Следует иметь в виду и учитывать при расчетах то обстоятельство, что обычный изопропиловый спирт представляет собой азеотропную (т.е. нераздельнокипящую) смесь 2-пропанола (88,0 %) и воды (12 %). Температура кипения этого азеотропа (80,4 °C) ниже, чем чистого 2-пропанола (82 °С).
2. Полученный продукт содержит некоторое количество диизопропилового эфира (Ткип 68 °С, nD20 1,368). Его можно удалить путем обработки органического слоя, тщательно отделенного от воды, концентрированной серной кислотой. Для этого органический слой переливают снова в делительную воронку, добавляют 5 мл концентрированной серной кислоты и встряхивают содержимое воронки (не переворачивая ее и убедившись заранее, что кран воронки при встряхивании не вылетит). Диизопропиловый эфир при этом переходит в сернокислотный слой, который отделяют, а оставшийся в делительной воронке бромистый изопропил промывают водой. Продукт тщательно отделяют от воды, высушивают безводным хлористым кальцием и перегоняют.
|
из
5.00
|
Обсуждение в статье: Основные теоретические положения. Электроотрицательные группы, присоединенные к углероду |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

