 |
Главная |
Теоретические основы кондуктометрического метода анализа. Аппаратура. Характеристика метода
|
из
5.00
|
Кондуктометрический метод анализа проводят в 2х вариантах:
1)прямая кондуктометрия
2)косвенная кондуктометрия (кондуктометрия титрования)
1. Прямая кондуктометрия
Кондуктометрический метод анализа основан на измерение удельной электропроводности в зависимости от концентрации анализируемого раствора. Для этого готовят ряд стандартных р-ров с известной концентрацией, измеряют электропроводность и строят график зависимости.

Затем определяют электропроводность анализируемого раствора и по графику определяют исходную концентрацию. Введу того что КМА отличается высокой точностью и простотой в аналитической практике он не нашел большого применения. Это связано с тем, что он не явл. специфическим, его электропроводность определяется суммой электропроводностей всех ионов находящихся в рас-ре , поэтому наличие даже малейших примесей искажают результаты, однако если работать с чистыми растворами то можно вычислить:
1) Кд- слабого электролита
2) ПР(произведение растворимости) мало диссоц. соед.
3) Константы нестойкости (Кн) комплексных соединений
4) рН р-ров, кислот и оснований.
5) Электрохимические показатели р-ра (χ, λ, α, fa-коэффициент электропроводности.
Достоинством метода явл возможность его использования в автоматическом контроле различных непрерывных хим. Производства.
2.Кондуктометрическое титрование
Является более распространенным методом по сравнению с прямой кондуктометрией. При сливании 2х р-ров в результате протекания хим. р-ции измеряется электропроводность р-ра, а т.к электропроводность р-ра будет зависеть только от концентрации появл. или исчезающих ионов, то посторонние ионы будут явл. как бы фоном на котором протекает хим. р-рция.
Кондуктометрическое титрование так де исполняет схему Кольрауша, только в место ячейки используется стакан куда помещается Pt электроды. Стакан ставят на магнитную мешалку.

При титрование всегда наступает момент который называют т-кой эквивалентности. Построив кривую в координатах, χ явл. объем приливаемого титранта χ=f(vтитранта) находят эту точку.
Т-ка эквивалентности будет выражена тем отчетливее, чем больше разница в подвижности титруемого иона и титранта.
1.титрование сильной кислоты сильным основанием.
NaOH
HCl→NaCl+H2O
H++Cl-+Na++OH-→Na++Cl-+ H2O
H++ OH-→ H2O

В начальный момент времени в р-ре имеется HCl катионы Н+ которые обладают самой большой подвижностью при титрование щелочи, ионы водорода ионами гидроксила в Н2О поэтому электропроводность резко убывает, в т-ке эквивалентности все ионы водорода связаны, а после нее в р-ре появляется избыток иона гидроксила которые обладают в двое меньшей подвижностью по сравнению с ионами Н+, поэтому электропроводность начинает расти, но в меньшей степени по сравнению с ионами Н+.
Ионы Cl- явл. фоном на котором протекает реакция.
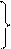
 λ∞H+≈350 8,9
λ∞H+≈350 8,9
λ∞Na+≈40
λ∞OH-≈174 4,5
λ∞Cl-≈60
2.титрование сильного основания сильной кислотой.
NaOH+HCl→NaCl+ H2O
Na++ OH-+ H++Cl-→ Na++Cl-+ H2O
H++ OH-→ H2O

3.титрование слабой к-ты сильным основанием.
CH3COOH+NaOH→CH3COONa+ H2O
CH3COOH+ Na++ OH-→ CH3COO-+ Na++ H2O
CH3COOH+ OH-→ CH3COO-+ H2O
Особенностью данного титрования явл. то что будучи слабой к-ой уксусная к-та образует мало ионов Н+ и следовательно электропроводность будет падать но не значительно, но т.к. в результате р-ции образуется ацетат натрия т.е. соль образованная слабой к-ой и сильным основанием,то в воде она будет подвергаться гидролизу.
CH3COONa+ H2O→ CH3COOH+ NaOH
CH3COO-+ Na++ H2O→ CH3COOH+ Na++ OH-
CH3COO-+ H2O→ CH3COOH+ OH-

4.титрование сильной и слабой кислот сильным основанием.
HСl, CH3COOH+NaOH→NaCl+ CH3COONa+ H2O
В данном случае сначало будет титроваться сильная кислота,
а затем слабая

V1 – объем пошедший на титрование сильной кислоты(HCl)
V3=V2-V1 объем щелочи пошедший на титрование слабой кислоты.
5.титрование сильной кислоты слабым основанием
HCl +NH4OH→ NH4Cl+ H2O
H++Cl-+ NH4OH→ NH4++ Cl-+ H2O
H++ NH4OH→ NH4++ H2O
Как и в 3м случае в результате такого титрования образуется гидролизирующаяся соль которая в воде образует слабое основание. В результате чего в р-ре появляются очень подвижные ионы Н+.
NH4Cl+ H2O→ NH4OH+ HCl
NH4++ Cl-+ H2O→ NH4OH+ H++Cl-
NH4++ H2O→ NH4OH +H+

6.титрование слабого основания слабой кислотой и на оборот.
NH4OH+ CH3COOH→ CH3COONH4+ H2O
NH4OH+ CH3COOH→CH3COO-+ NH4++ H2O

7.титрование соли солью с образованием осадка.
BaCl2+Na2SO4→2NaCl+BaSO4
Ba2++2Cl-+2Na++SO42-→2Na++2Cl-+ BaSO4↓
Ba2++ SO42-→ BaSO4↓

Характеристика кондуктометрии.
1. Точный
2. Объективный
3. Можно титровать мутные растворы
4. Можно одновременно определять несколько ионов
5. Можно использовать в автоматическом режиме
6. Агрессивные средs, водные и не водные рас-ры(Br).
|
из
5.00
|
Обсуждение в статье: Теоретические основы кондуктометрического метода анализа. Аппаратура. Характеристика метода |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

