 |
Главная |
Теоретические основы полярографисекого метода анализа. Аппаратура. Характеристика метода
|
из
5.00
|
Полярография –это один из важнейших методов электрохимических методов анализа.
В основе его лежит процесс электролиза сопровождающий окислением или восстановлением определяемого в-ва на поверхности электрона. Если рассматривать электрохимические методы анализа, то можно сказать, что кондуктометрия и потенциометрия не сопровождаются процессами переноса в-ва и протекают при силе тока =0.
В полярографии и электрогравиметрическом методе анализа электролиз сопровождается процессом переноса в-ва и проводится при силе тока ≠ 0. Полярографический метод анализа был открыт Я. Гейровским в 1922г. В споре с японским ученым Шикато был создан первый полярограф.
В настоящее время полярография явл. одним из электро хим. методов анализа. В 1959г. Гейровский получил нобелевскую премию.
Электорхим. метод в основе которого лежит зависимость между характером поляризованного рабочего электрода и составом р-ра н аз-ся полярографическим методом анализа.
Слово полярография означает запись процесса поляризации.
Полярографическая кривая строится в координатах сила тока (J) и напряжения, поэтому она называется вольт амперной кривой.

Вольтамперная кривая в отличие от всех прочих методов позволяет одновременно проводить как качественный, так и количественный анализ.

Е1/2-наз. потенциалом полуволны и явл. величиной характеризующей природу определяемого иона.
h- высота полярографической волны, она зависит от концентрации определенного иона.
Характеристика метода.
1.довольно простой в проведение.
2.обладает высокой точностью.
3. имеет высокую чувствительность.
4.быстр в исполнении (явл. экспрессным).
5.позволяет определять сразу несколько компонентов смеси.
6.можно использовать водные и не водные р-ры.
7.применим для анализа органических в-в.
8.одновременное проведение качественного и количественного анализа.
9.легко поддается автоматическому контролю.
10.возможно не однократное определение состава одной и той же пробы.
Области применения.
1.для исследования механизма многих электро химических реакций и процессов.
2.для изучения состава, строения и устойчивости космплексных соединений.
3.для изучения кинетики многих процессов.
4.для определения целого ряда физ.хим. констант.
Поляризацией называется процесс изменения равновесного электродного потенциала, при прохождении через электролит постоянного электрического тока, что бы пошел электродный процесс нужно приложить напряжение несколько больше чем то что рассчитывается по ур-ю Нернста(Е0).
Ереал=Е0+∆Е
∆Е=Ереал-Е0
∆Е-потенциал поляризации.
Значение нормального электродного потенциала определяется материалом электрода и может изменятся при изменение его поверхность.
Возникающую при этом поляризацию наз. электродной или химической.
Если изменение электродного потенциала связано с концентрацией потенциал образующих ионов в приэлектродном слое р-ра электролита, то такая поляризация наз. концентрационной.
В полярографическом методе анализа важна концентрационная поляризация, а в электрогравиметрическом методе анализа электродная.
В зависимости от того будет поляризующийся электрод катодом или анодом электролитической ячейки, причиной поляризации будут либо восстановительный либо окислительный процессы. При этом потенциал будет сдвигаться либо в «+» либо в «-».
Весь электродный процесс протекающий на электродах или в приэлектродном слое, можно рассматривать как совокупность ряда процессов протекающих при приложенном напряжении.
Любой процесс в самом простейшем случае модно разделить на 3 стадии:
1)доставка в-ва из общей массы к поверхности электрода (диффузия)
2)собственно электорохим-я р-ция(восстановление или окисление)
3)образование новой фазы конечного продукта
2Н++2е→Н2↑
Ме2++nе→Ме0
Из кинетики известно если р-ция протекает в несколько стадий то лимитирующей явл. самая медленная из 3х ваше перечисленных самая медленная явл. 1. Ее скорость определяется диффузией, при этом возникает концентрац-я поляр-я. Скорость этой стадии определяется кинетический уравнением.
ν1=K(C0-Cэ)
K-конст. Скорости
C0- концентрация определенного иона в р-ре
Cэ –концентрация того же иона в приэлектродном слое
(C0-Cэ)- градиент концентрации
Слой в котором возникает градиент концентрации называется диффузионным.
Скорость подачи ионов электроду может быть оценена как кол-во моль в-ва диффундирующих к электроду в единицу времени в расчете на единицу поверхности электрода ν2= υ/S при наступлении равновесия ν1=ν2
υ/S=k(Co-Cэ) (1)
k-коэффициент зависимости от диффузии
чем быстрее перемещается ион, тем больше скорость подачи его к электроду, тем больший путь он может пройти.
Коэффициент диффузии определяется k=D/ℓ (2)
D –коэффициент диффузии данного иона
ℓ-толщина данного слоя
(2)→(1)
 |*ZF ( умножаем обе части уравнения на ZF)
|*ZF ( умножаем обе части уравнения на ZF)
 (3)
(3)
 =is – плотность тока проходящая через электролитическую ячейку
=is – плотность тока проходящая через электролитическую ячейку
is= 
is=  |*S (умножаем обе части на S-поверхность электрода)
|*S (умножаем обе части на S-поверхность электрода)
is*S= 
is*S=i- плотность тока
 =iд- дифференциальный ток
=iд- дифференциальный ток
i=iд*Co-iдCэ (делим правую часть уравнения на Со)
i=  ; i=
; i=  ; i-iд=
; i-iд=  ;
;  |*(-1)
|*(-1)
 ;
; 
С другой стороны сдвиг потенциала определяется уравнением
∆Е=Ереал-Е0 (4)
Ереал ~Е(Сэ) ; Е0~Е(Со)
Е=Е0+ 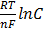 (5)
(5)
∆E=E0+  -Е0-
-Е0- 
∆Е= 
В полученное уравнение подставляем Сэ/Со=….
∆Е=  уравнение концентрационной поляризации
уравнение концентрационной поляризации
∆Е= 
Кроме того в полярографии известно уравнение Ильковича которое описывает зависимость дифференциального тока от концентрации анализируемого иона.
iд=605zD1/2τ1/6m3/2Co
z-количество электронов участвующих в электрохимической реакции
D –коэф-т диф-ции
τ – время жизни капли ртути
m-масса капли ртути
Co-концентрация опред. иона в растворе
В полярографии используют электроды которые резко по своей поверхности. Поляризуется электрод с очень малой рабочей поверхностью,
S=2÷3 мм2, называется микроэлектрод.
 Электрод имеющий большую поверхность наз-ся макроэлектродом (ртуть на дне стакана).
Электрод имеющий большую поверхность наз-ся макроэлектродом (ртуть на дне стакана).
Ртутный капельный электрод.
Индикаторным электродом полярографического метода анализа явл. ртутно-капельный электрод.
Ртутно-капельный электрод явл. микроэлектродом, он был предложен Гейровским.
Состоит он из стеклянного сосуда(1) соединительной трубки(2) и капилляра(3).Сосуд заполняется ртутью, капилляр имеет внутренний диаметр от 0,01 до 0,05 мм и изготавливается из толстостенного стекла, период капанья составляет от 2-х до 3-х сек. в ртуть помещается платиновый электрод служащий для подвода и отвода электродов, ртуть капает в стакан в котором содержится анализируемый раствор, на дне сосуда располагается слой металлической ртути, которая выполняет роль макроэлектрода. Здесь так же имеется 2-й вывод.
Электрохимический процесс происходит на поверхности ртутной капли в течении того времени, когда капля висит на кончике капилляра, время в течении которого капля висит на кончике капилляра наз. временем жизни.
На макро и микро электрод от внешнего источника постоянного тока подается плавно меняющееся напряжение, а т.к. поверхности электродов отличаются во много раз, то плотность тока на макроэлектроде, будет ничтожно малой и следовательно его потенциал будет практически постоянный, на микроэлектроде в следствие малой поверхности плотность тока будет значительной следовательно в этих условиях поляризоваться будет ртутно-капельный электрод. При прохождении постоянного тока именно он будет изменять свой равновесный потенциал и на нем будет наблюдаться сдвиг потенциала ∆Е.
Характеристика ртутно-капельного электрода.
1.поверхность ртутной капли непрерывно обновляется поэтому метод характеризуется высокой воспроизводимостью результатов.
2.Ртуть практически не заменима потому что на ней катионы большинства металлов восстанавливаются легче чем на платине.
3.Т.к. на ртути водород выделяется с огромным перенапряжением, то водород восстанавливается после всех металлов.
Недостатки
1.ртуть
2.ртуть нельзя использовать в области положительных потенциалов
3.при вытекании капли ртути из капилляра регулярно меняется его масса и соответственно поверхность на которой происходит электрохимическая реакция, поэтому вместо ровной полярограммы получается асцилографическая полярограмма, что бы избавится от этого параллельно гальванометру ставится шунт.


4.Т.к. капля ртути падает на дно стакана через раствор в процессе падения она его перемешивает в результате чего на вольт амперной кривой появляется скачек. Что бы избавится от этого в анализируемый р-р добавляют ПАВ

Схема полярографической установки.

От источника постоянного тока (1) напряжение подается на реохорд АВ (4). Электролетическая ячейка (5) содержит в качестве макро электрода ртуть (6), в качестве микра электрода ртутно-капельнай электрод (7). Ток регистрируется гальванометром (8). По реохорду движется подвижный контакт К (3). Ячейка заполнена анализируемым раствором.
Медленно передвигая контакт от исходной т-ки А постепенно набирает напряжение при этом изменяется сила тока.
Кривую потенциометрического анализа можно вычерчивать по показаниям прибора, либо прибор снабжается самописцем и полярограмму ваписывает потенциометр. Для уменьшения асцелографирования полярограммы параллельно гальванометру ставится шунт(9).
Качественный полярографический анализ.
Потенциал полуволны явл. табличной характеристикой ионов. Полярограмма строится в координатах J от напряжения, поэтому ее часто называют вольтамперной кривой.

Е1/2-табличная величина.
Если в растворе содержится не один компонент, а несколько, то на вольтамперной кривой будет столько скачков сколько компанентов содержится в рас-ре.

Качественный полярографический метод анализа основан на измерении потенциала полуволн, для этого снимают полярограмму от 0 до 2 волн, на фоне определенного электролита, в полярографических таблицах приведены не только ионы, но и электролитный фон на котором проводится данный анализ.
Если в р-ре содержится не один определяемый ион, а несколько, то вольтамперная кривая получается качественная, если разница между потенциалами полуволн не будет превышать 0,2 В.
С помощью данного метода можно анализировать ступенчатое постановление многозарядных ионов.
Cu2+→Cu++Cu

Если между потенциалами полуволн нет разницы в 0,2 В: например у Ni Е1/2=-1,1 И, а у Co Е1/2=-1,2B то в этом случае можно поменять среду на пр. использовав аллюмийно- аммиачный буферный р-р Ni Е1/2=-1,09 В, Co Е1/2=-1,4B.
Кроме того если нужно проанализировать 1 ион, а 2й мешается, то аго можно закомплексовать, полученный чувственной характеристикой явл. высота волны.
Качественный метод полярогафии
1.метод расчета
В основу метода положено ур-е Ильковича.
i=605zFB2/3D1/2τ1/6с
c= 
В р-р опускают ртутно-капельный электрод и измеряют диффузионный ток, который = высоте вольтамперной кривой.
Ртутный капельный электрод, как правило, снабжен паспортом, в котором указывается масса(m) вытекающей капли и время ее жизни. Коэффициент диффузии берется из таблиц, в зависимости от того с каким р-ром работают. Свидя все все постоянные величины в одну получают уравнение
Сх=1/кD1/2
Применяется редко в виду того что D (коэффициент диффузии) не всегда можно определить точно и особенно для концентрированных р-ров, метод дает большую ошибку.
2.метод калибровочного графика
Прежде чем преступить к анализу в-ва с неизвестной концентрацией, готовят ряд стандартных растворов, затем полярогрофируют каждый из них. Строят графики зависимости J=f(E)


3.стандартное титрование
В отличие от предыдущего метода в этом случае готовят только 1 стандартный р-р. Снимают полярограмму, затем полярогрофигуют стандартный р-р по Сх= Ссm 
Недостатки метода явл. то что р-р надо готовить каждый раз и в концентрации ≈анализируемого р-ра. Он более точный.
4.метод добавок с начало снимают полярограмму анализируемого р-ра, затем в тот же р-р по каплям приливают стандартный р-р определ. иона с точно известной концентрацией в таком количестве что бы высота В-А кривой выросла примерно в 2е, затем снимают окончательную полярограмму и тогда С можно определить по ур-ю
Сх= 
А т.к Vx не удобно измерять то V переходит h (высота волны)
h общ =hх +hсm
hсm= h общ- hх Сх=Сcm 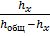
если анализы проводят массовым порядком, то для их ускорения вводят коэффициент К.
К=  Сх=hх/К
Сх=hх/К
|
из
5.00
|
Обсуждение в статье: Теоретические основы полярографисекого метода анализа. Аппаратура. Характеристика метода |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

