 |
Главная |
Andio R., D. Silvera, S. D. Suggett, P. L. Achacoso, 3 страница
|
из
5.00
|

|
| Рис. 12.15. Кластер генов биосинтеза ароматических поликетидных антибиотиков актинородина (act), тетраценомицина (tcm), френолицина (fren) и гризеузина (gris). Каждый кластер содержит гены, кодирующие минимальную поликетидсинтазу, которая отвечает за синтез поликетидного остова. Ферменты, кодируемые другими генами, катализируют реакции его модификации. Сужающийся «конец» гена указывает направление его транскрипции. |
264 ГЛАВА 12

| Рис. 12.16. Искусственно созданные пути биосинтеза поликетидных антибиотиков SEK43 и SEK26- Обозначения: act — актинородин, tст — тетраценомицин, fren — френолицин, gris -гризеузин, min PKS — минимальная поликетидсинтаза, KR — ß-кеторедуктаза. ARO -ароматаза, CYC — цикл а за. |
Одна из стратегий, используемых некоторыми аэробными микроорганизмами для выживания в условиях недостатка кислорода, состоит в синтезе гемоглобинподобного продукта, способного аккумулировать кислород и доставлять его в клетки. Например, аэробная бактерия Vitreoscilla sp. синтезирует гомодимерный гемсодержащий белок, функционально подобный эукариотическому гемоглобину. Ген «гемоглобина» Vitreoscilla
был выделен, встроен в плазмидный вектор Streptomyces и введен в клетки этого микроорганизма. После его экспрессии на долю гемоглобина Vitreoscilla приходилось примерно 0,1% всех клеточных белков S. coelicolor даже в том случае, когда экспрессия осуществлялась под контролем собственного промотора гена гемоглобина Vitreoscilla, а не промотора Streptomyces. Трансформированные клетки S. coelicolor, растущие
Использование рекомбинантных микроорганизмов для получения коммерческих продуктов 265

| ||
| Получение 2-кето-L-гулоната промежуточного продукта синтеза L- аскорбиновой кислоты — с помощью рекомбинантной бактерии Erwinia herbicola | ||
| S. Anderson, С. В, Marks, R. Lazarus. J. Miller, K. Stafford, J. Serymour, D. Light, W. Rastetter, D, Este» Science 230: 144-149, 1985 | ||
| Для направленного изменения прокариот, синтезирующих определенные метаболиты, в принципе есть два пути. Во-первых, можно изменить активность или содержание одного или нескольких ферментов того или иного биосинтетического пути с тем, чтобы увеличить продукцию нужного метаболита. Во-вторых, в прокариотический геном можно ввести чужеродные гены, кодирующие ферменты, которые, используя эндогенный метаболит в качестве субстрата, обеспечат синтез метаболита, изначально не продуцируемого хозяйской клеткой. Такого рода манипуляции представляются достаточно простыми, однако далеко не всегда | удается выделить нужный ген и подобрать подходящие условия для его экспрессии. Чтобы создать бактерию, синтезирующую 2-кето-L-гулоновую кислоту, непосредственного предшественника витамина С в промышленном производстве этого витамина, Андерсон и др. выделили из Corynebacterium ген фермента, катализирующего превращение 2,5-дикето-D-глюконовой кислоты в 2-кето-L-гулоновую кислоту, и ввели этот ген в клетки Erwinia sp. — бактерии, синтезирующей 2,5-дикето-Dглюконовую кислоту из D-глюкозы. Выделение этого гена осложнялось тем, что сам фермент практически не был изучен. Та- | ким образом, прежде чем идентифицировать ген, нужно было очистить соответствующий белок и частично секвенировать его, а затем на основании данных об аминокислотной последовательности сконструировать зонды для гибридизации. Это была одна из первых работ, относящихся к той области исследований, которую иногда называют инженерией метаболизма. В такого рода работах из одного микроорганизма в другой переносят гены, ответственные за какую-то часть метаболического пути, так что второй микроорганизм приобретает способность синтезировать новые метаболиты. |
при низком содержании растворенного кислорода (примерно 5% от насыщающей концентрации), синтезировали в 10 раз больше актинородина на 1 г сухой клеточной массы и имели большую скорость роста, чем нетрансформированные. Этот подход можно использовать и для обеспечения кислородом других микроорганизмов, растущих в условиях недостатка кислорода. Исходным материалом при химическом синтезе некоторых цефалоспоринов — антибиотиков, обладающих незначительным побочным эффектом и активных в отношении множества бактерий, — является 7-аминоцефалоспорано-вая кислота (7АСА), которая в свою очередь синтезируется из антибиотика цефалоспорина С (рис. 12,11 ). К сожалению, природных микроорганизмов, способных синтезировать 7АСА, до сих пор не выявлено. Новый путь биосинтеза 7АСА был сконструирован включением специфических генов в плазмиду гриба Acremonium chrysogenum, который обычно синтеризует только цефалоспорин С. Один из этих генов был представлен кДНК гриба Fusarium solani, кодирующей оксидазу D-аминокислот, а другой происходил из геномной ДНК Pseudomonas diminuta и кодировал цефалоспоринацилазу. В плазмиде гены находились под контролем промотора A. chrysogenum. На первом этапе нового биосинтетического пути цефалоспорин С превращается в 7-β-(5-карбокси-5-оксопентанамид)цефалоспорановую кислоту (кето-АD-7АСА) при помощи оксидазы D-аминокислот (рис. 12.17). Часть этого продукта, вступая в реакцию с пероксидом водорода, одним из побочных продуктов, превращается в 7-р-(4-карбоксибутанамид)цефалоспорановую кислоту (GL-7ACA). И цефалоспорин С, и кето-АD-7АСА, и GL-7ACA могут подвергаться гидролизу цефалоспоринацилазой с образованием 7АСА, однако только 5% цефалоспорина С напрямую гидролизуется до 7АСА. Следовательно, для образования 7АСА с высоким выходом необходимы оба фермента.
266 ГЛАВА 12

| Рнс. 12.17. Генетически сконструированный путь биосинтеза 7-аминоцефалоспорановой кислоты (7АСА) из цефалоспорина С. Ген оксидазы D-аминокислот выделен из гриба F. solani, a ген цефалоспоринацилазы - из бактерии P. diminuta. |
Биополимеры
Биополимеры — это высокомолекулярные соединения, синтезируемые живыми организмами. Некоторые из них обладают ценными физическими и химическими свойствами и могут использоваться в пищевой, перерабатывающей и фармацевтической промышленности. С возникновением технологии рекомбинантных ДНК появилась возможность создавать новые биополимеры, заменять синтетические продукты их биологическими аналогами, модифицировать уже существующие биополимеры с целью улучшения их физических и структурных характеристик, повышать эффективность соответствующих промышленных процессов, уменьшать их стоимость.
Создание рекомбинантной бактерии Xanthomonas campestris с целью получения ксантановой слизи
Xanthomonas campestris — грамотрицательная облигатно аэробная почвенная бактерия, синтезирующая ценный коммерческий биополимер ксантановую слизь, высокомолекулярный экзополисахарид Его структурный каркас составляет линейная полимерная цепь из молекул глюкозы. К каждому второму глюкозному остатку присоединена трисахаридная боковая цепь, состоящая из однго остатка глюкуроновой кислоты и двух остатков маннозы (рис. 12,18). Ксантановая слизь имеет высокую вязкость, не разрушается в агрессивных физических и химических средах и по физическим и химическим свойствам напоминает пластик. В частности, ее можно использовать как стабилизирующий, эмульгирующий, загущающий или суспендирующий агент. Для успешного коммерческого производства ксантановой слизи необходимо выращивать X. campestris на недорогом и доступном источнике углерода. X. campestris дикого типа эффективно утилизирует глюкозу, сахарозу и крахмал, но не лактозу. При производстве сыра в большом количестве образуется такой побочный продукт, как сыворотка. Она состоит из воды (94—95%), лактозы (3,5—4%) и небольших количеств белка, минеральных веществ и низкомолекулярных органических соединений. Огромные количества сыворотки дает молочная промышленность, и ее утилизация — это большая проблема. Часто сыворотку сливают в реки и озера, что приводит к уменьшению в них количества доступного кислорода и гибели многих водных организмов. Транспортировка сыворотки к местам захоронения мусора обходится очень дорого, к тому же серьезную проблему создает риск загрязнения ею грунтовых вод. Наконец, большие средства уходят на удаление твердых компонентов сыворотки. Все это заставило попытаться найти способы выгодной переработки сыворотки.
Сыворотку можно использовать как источник углерода при выращивании ценных промышлен-
Использование рекомбинантныхмикроорганизмов для получения коммерческих продуктов 267
| Рис. 12.18. Структурная формула полисахарида, образующего ксантановую слизь. Каркас составляет линейная полимерная цепь из молекул глюкозы. К каждому второму остатку присоединена трисахаридная боковая цепь. | 
|
ных микроорганизмов. Чтобы X. campestris приобрела способность расти на сыворотке, было проделано следующее. Гены lacZY E. coli, кодирующие ферменты ß-галактозидазу и лактозо-пермеазу, встроили в плазмиду с широким кругом хозяев так, чтобы они находились под транскрипционным контролем промотора одного из бактериофагов X. campestris. Эту конструкцию ввели в Е. coli, а затем перенесли из E. coli в X. campestris тройным скрещиванием. Трансформанты, содержащие плазмиду, синтезировали ß-галактозидазу и лактозопермеазу, используя лактозу как единственный источник углерода, а также продуцировали в больших количествах ксантановую слизь, используя в качестве источников углерода глюкозу, лактозу и сыворотку (табл. 12.4). Подчеркнем еще раз, что X. campesfrïs дикого типа синтезирует много ксантановой слизи, только когда растет на глюкозе.
Выделение генов биосинтеза меланина
Меланины образуют многочисленное семейство различных поглощающих свет биополимеров; их синтеризуют животные, растения, бактерии и грибы. Эти пигменты можно было бы использовать при изготовлении солнцезащитных экранов и покрытий, в качестве добавки к косметическим средствам. В настоящее время меланины получают в небольших количествах либо экстракцией из природных источников, либо путем химического синтеза. С помощью технологии рекомбинантных ДНК, возможно, удастся создать недорогое крупномасштабное производство меланинов с различными физическими свойствами.
| Таблица 12,4, Синтез ксантановой слизи в трансформированных клетках Х. campestris и клетках дикого типа, растущих в среде с разными источниками углерода 1) | |||
| X. campestris | Количество ксантановой слизи, мкг/мл1) | ||
| 0,4% глюкоза | 0,4% лактоза | 10% сыворотка | |
| Дикий тип | |||
| Трансформант | |||
| 1) По данным работы Fu, Tseng, Appl. Environ. Micibbioi. Sfc 919—923, 1990. | |||
| 2) Количество образующегося продукта выражено б числе микрограммов на 1 мл культуры, растущей на минимальной среде в присутствии 0,4% глюкозы или 0,4% лактозы либо на разбавленной (10%) сыворотке, содержащей примерно 0, 4% лактозы. Трансформант содержит плазмиду, несущую гены lacZY E. coli. |
268ГЛАВА 12
Меланины -- это нерегулярные полимеры, состоящие из остатков индола, бензотиазола и аминокислот. Первый этап их биосинтеза катализируется медьсодержащим ферментом моно-оксигеназой тирозиназы и представляет собой окисление тирозина до дигидроксифенилаланинхинона. Последние этапы полимеризации не являются каталитическими реакциями и в зависимости от химической природы нехинонных соединений, включающихся в полимерную структуру, дают конечные продукты разных цветов: черного, коричневого, желтого, красного или фиолетового.
Выделены и охарактеризованы гены биосинтеза меланина в бактериальных клетках Streplomyces antibioticus. Они содержат две открытые рамки считывания (ORF), одна из которых кодирует тирозиназу (мол. масса 30 600), а вторая (ORF438) — белок (мол, масса примерно 14 800) с неизвестными функциями. Чтобы проверить, нужны ли оба этих гена для синтеза меланина, гены сначала переклонировали в экспрессирующий вектор Е. соli, при этом одна конструкция содержала только ген тирозиназы, а другая — и ген тирозиназы, и ORF438 (рис. 12.19). Вектор, несущий ген тирозиназы, обеспечивал синтез больших количеств тирозиназы, чем вектор, содержащий оба указанных гена. Однако оказалось, что уровень тирозиназы не имеет особого значения, а для биосинтеза меланина необходимы продукты обоих генов. Возможно, белок, кодируемый ORF438, поставляет ионы меди неактивному предшественнику тирозиназы апотирозиназе, которая активируется в их присутствии. В естественных условиях после образования дигидроксифенилаланинхинона при участии тирозиназы в полимер включаются различные низкомолекулярные соединения (нехиноны). С учетом этого можно изменять химические и физические свойства меланина, синтезируемого в клетках E. coli с введенными в них ключевыми генами биосинтеза этого полимера, если добавлять в среду определенные низкомолекулярные соединения в разных количествах.
Микробиологический синтез животного биополимера с адгезивными свойствами
Весьма перспективной представляется также разработка недорогого способа получения белка с адгезивными свойствами, впервые выделенного из мидий Mytilus edulis. Этот водостойкий белок образует очень прочные нити, с помощью которых моллюски прикрепляются к разнообразным поверхностям. Сразу после секреции биополимера так называемой биссаловой железой между полимерными цепями образуются многочисленные поперечные сшивки, что затрудняет определение их аминокислотной последовательности. Это в свою очередь не позволяет установить нуклеотидную последовательность кодирующих их генов и синтезировать гибридизационные зонды. К счастью, удалось выделить внутриклеточный предшественник адгезивного белка (130 кДа-предшественник). Как показали биохимические исследования, он богат серином, треонином, лизином, пролином и тирозином. От 60 до 70% этих аминокислот содержат гидроксильную группу, при этом большинство остатков пролина и тирозина гидроксилированы до 3- или 4-гидроксипролина (Hyp) и 3,4-дигидроксифенилаланина (DOPA) соответственно. Кроме того, после определения аминокислотной последовательности выяснилось, что предшественник состоит в основном из повторяющихся декапепти-

| Рис. 12.19. Экспрессирующие плазмиды E. coti, несущие гены биосинтеза меланина. рВСС619 содержит ген тирозиназы, a pBGC620.3 — открытую рамку считывания (ORF438) для синтеза меланина и ген тирозиназы. Транскрипция клонированных генов осуществляется под контролем промотора РT7 бактериофага Т7. RBS1 и RBS2 -два разных сайта связывания рибосом. Обе плазмиды несут гены устойчивости к ампициллину (Ampr). |
Использование рекомбинантныхмикроорганизмов для получения коммерческихпродуктов 269

|
| Рис. 12.20. Синтетический олигонуклеотид, послуживший основой для создания гена адгезивного белка, синтезируемого мидией M. edulis. Второй синтетический олигонуклеотид был синтезирован таким образом, чтобы после отжига с первым образовывался фрагмент двухцепочечной ДНК с липкими концами. Последующее лигирование с помощью ДHК-лигазы фага Т4 привело к образованию линейной ДНК, состоящей из представленных на рисунке повторов. Внизу дана аминокислотная последовательность полипептида, кодируемого этим повтором. |
дов Ala-Lys-(Pro или Hyp)-Ser-(Tyr или DOPA)-Hyp-Hyp-Thr-DOPA-Lys.
Из библиотеки кДНК, которая была получена на основе мРНК, выделенной из биссаловой железы, была изолирована кДНК 130 кДа-предшественника адгезивного белка. И адгезивный белок, и его кДНК обладают весьма необычными свойствами, затрудняющими клонирование и экспрессию соответствующих генов и получение функционального адгезивного белка. Во-первых, кДНК содержит большое число повторов, что повышает частоту гомологичной рекомбинации и вероятность утраты части клонированной последовательности. Во-вторых, поскольку примерно 70% всех аминокислот белка приходится на долю пролина, лизина и тирозина, вряд ли его удастся получить в большом количестве вследствие ограниченности внутриклеточного пула аминоацил-тРНК.
Чтобы преодолеть все эти трудности, полноразмерную кДНК адгезивного белка или ее фрагменты встроили в дрожжевые экспрессирующие векторы и ввели эти векторы в дрожжевые клетки. После экспрессии были получены новые активные формы адгезивного белка мол. массой от 20 до 100 кДа, причем на их долю приходилось от 2 до 5% суммарного количества клеточных белков. Значительно более высокого уровня экспрессии удалось достичь после того, как был химически синтезирован ген адгезивного белка (рис, 12.20). Используя повторы ДНК, кодирующие декапептид адгезивного белка, создали синтетический ген длиной 600 п. н., который кодировал белок мол. массой примерно 25 кДа. Его основная повторяющаяся единица длиной 30 п. н. состояла из кодонов, оптимальных для экспрессии в Е. соli, а эффективнаяэкспрессия происходила, когда он находился под контролем промотора фага Т7. Большинство микроорганизмов обладают лишь ограниченной способностью осуществлять посттрансляционное гидроксилирование аминокислот, так что образующийся белок бывает не до конца гидроксилирован. Так, некоторые из его тирозиновых остатков не превращаются в DOPA, что снижает число образующихся поперечных сшивок. Чтобы решить эту проблему, была создана система гидроксилирования in vitro, в которой бактериальная тирозиназа в присутствии аскорбиновой кислоты гидрокcилировала остатки тирозина (рис. 12.21). Аскорбиновую кислоту добавляли в реакционную смесь для того, чтобы предотвра-
| Рbс. 12.21. Посттрансляционное гидроксилирование in vitro некоторых тирозиновых остатков адгезивного белка М. edulis. При участии тирозиназы тирозин превращается в DOPA, после чего он может быть окислен до о-хинона катехолоксидазой или тирозиназой. Окисление можно предотвратить добавлением аскорбиновой кислоты. | 
|
270 ГЛАВА 12
тить окисление остатков DOPA в о-хинон. Этот процесс должен строго контролироваться, поскольку он приводит к сшиванию субъединиц адгезивного белка. Как и многие другие клеи или адгезивы, адгезивный белок необходимо активировать непосредственно перед использованием.
При окислении предшественника адгезивного белка и образовании сшивок белок может связываться с разнообразными поверхностями -из стекла, полистирола, коллагена и т. д. Прочность и специфичность связывания можно изменять добавлением к смеси адгезивных белков до окисления и образования сшивок других белков. Это позволяет создавать клеи с уникальными свойствами, в том числе и такие, которые можно будет использовать в медицине, в частности в стоматологии.
Микробиологический синтез каучука
Натуральный каучук, цис-1,4-полиизопрен, – это широко используемый биополимер, который получают из различных растений. Его биосинтез начинается с превращения простых Сахаров и включает 17 ферментативных реакций. В ходе последней из них происходит полимеризация изопентенилпирофосфата с образованием аллилпирофосфата.
Ввиду большой коммерческой ценности каучука были проведены исследования, направленные на то, чтобы выяснить, можно ли использовать для его получения рекомби-нантные микроорганизмы. Прежде всего с помощью мРНК из растения Hevea brasiliensis, синтезирующего каучук, была создана соответствующая к ДНК-библиотека. Затем проведена гибридизация с коротким ДНК-зондом, синтезированным исходя изданных об аминокислотной последовательности одного из участков молекулы полимеразы каучука. Для того чтобы доказать, что клонированная кДНК действительно кодирует этот фермент, использовали антитела к очищенному ферменту. Теперь, используя этот клон кДНК, а также, возможно, другие гены биосинтеза каучука, можно попытаться синтезировать натуральный каучук микробиологическими методами. С другой стороны, с помощью этой кДНК можно также получить полимеразу каучука и создать каталитическую систему in vitro. В любом случае исследования, которые могли бы привести к разработке нового пути биосинтеза каучука, имеет смысл продолжить.
Микробиологический синтез полигидроксиалканоатов
Полигидроксиалканоаты — это биодеградируемые полимеры, синтезируемые множеством микроорганизмов (прежде всего Alcaligenes eutrophus) и использующиеся ими как внутриклеточный источник углерода и энергии. Они обладают разными свойствами в зависимости от состава и могут применяться для получения биодеградируемых пластмасс, используемых, например, для изготовления упаковочного материала. По оценкам, годовой объем продаж биодеградируемых пластмасс составляет примерно 1,3 млрд. долларов.
Из всех полигидроксиалканоатов наиболее полно изучена и охарактеризована поли(3-гидроксимасляная кислота). Это относится как к самому полимеру, так и к кодирующим его синтез генам A. eutrophus. Поли(3-гидрокси-масляную кислоту), ее сополимер поли(3-гид-роксибутират-со-3-гидроксивалерат) и другой полиоксиалканоат, поли(3-гидроксивалериановую кислоту), получают в Великобритании в промышленном масштабе ферментацией при участии A. eutrophus.
Однако этот микроорганизм растет относительно медленно и использует лишь ограниченное число источников углерода, что делает производство довольно дорогим. Можно использовать другой путь: при перенесении генов биосинтеза этого полимера в E. coli получаются быстрорастущие трансформанты, накапливающие в большом количестве (до 95% сухой массы клетки) поли(3-гидроксимасляную кислоту). Поли(3-гидроксимасляная кислота) синтезируется из ацетилСоА в три стадии, катализируемые тремя разными ферментами (рис. 12,22). Оперон, содержащий эти гены, был встроен в плазмиду в составе фрагмента длиной 5,2 т.п.н., однако в отсутствие селективного давления, например при росте в отсутствие антибиотиков, примерно половина клеток E. coli теряла данную плазмиду уже после 50 генераций. Это не очень существенно, когда масштабы культивирования малы, но становит-
Использование рекомбинантных микроорганизмов для получениякоммерческих продуктов 271

|
| Рис. 12.22. Синтез поли(3-гидроксимасляной кислоты) из ацетил-СоА, Справа от стрелок указаны ферменты, катализируюшие соответствуюшие реакции. |
ся серьезной проблемой при крупномасштабной или непрерывной ферментации (см. гл. 16). Чтобы обойти эту трудность, в плазмиду, несущую оперон поли(3-гидроксимасляной кислоты), встроили локус parВ из другой плазмиды, который обеспечивал стабилизацию плазмид, обусловливая гибель клеток, не содержащих плазмиды после сегрегации. Модифицированные плазмиды оставались стабильными даже при конститутивном синтезе поли(3-гидроксимасляной кислоты). Трансформанты Е. coli, синтезирующие данный продукт, образовывали лишь очень небольшое количество ацетата, гибельного для клеток, по-видимому, вследствие того, что весь избыточный ацетил-СоА превращался в поли(3-гидроксимасляную кислоту), а не в ацетат. Еще одно преимущество синтеза поли(3-гидроксимасляной кислоты) в E. coli состоит в том, что когда ее экстрагируют щелочным раствором хлорноватистокислого натрия (калия), то она разлагается в меньшей степени, чем при экстракции из A. eutrophus. По-видимому, это связано с тем, что большая часть полимера, синтезируемого в E. coli, находится в кристаллическом виде, в то время как в A. eutrophus — в аморфном. При этом полимеры, получаемые этими двумя способами, идентичны.
Поли(3-гидроксибутират-со-3-гидроксива-лерат) аналогичен по своим свойствам широко использующемуся полипропилену, так что получение его микробиологическими методами может представлять коммерческий интерес. Однако штаммы E. coli, в которых экспрессируются гены биосинтеза полимера, синтезируют только поли(3-гидроксимасляную кислоту), а не сополимер. Эту проблему можно решить, используя для экспрессии клетки E. coli, несущие мутации в локусах fadR и atoC. fadR ответствен за негативную регуляцию биосинтеза жирных кислот, a atoC — за позитивную регуляцию их поглощения. Роль локуса fааR в индукции биосинтеза сополимера неясна, но продукт гена atoC влияет на синтез белков, кодируемых генами atoA и atoD и облегчающих поглощение бактериями пропионата из культуральной среды. Последний превращается в пропионил-СоА и затем реагирует с ацетил-СоА с образованием 3-
| Рис. 12.23. Микробиологический синтез поли(3-гидроксибутирата-со- 3- гидроксивалерата). | 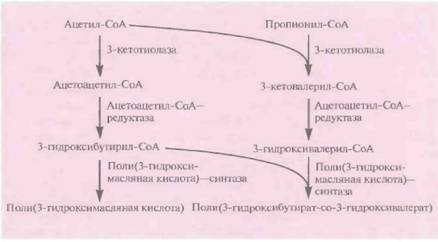
|
272ГЛАВА 12
кетовалерил-СоА, который в свою очередь может превращаться в 3-гидроксивалерил-СоА, включаемый в сополимер (рис, 12.23),
ЗАКЛЮЧЕНИЕ
Бактерии можно не только использовать как «фабрики» для синтеза белков типа рестриктаз, но и получать с их помощью новые продукты, изменяя метаболизм бактериальных клеток введением в них чужеродных генов или модификацией уже существующих. Можно создавать рекомбинантные микроорганизмы, способные синтезировать самые разные низкомолекулярные соединения: L-аскорбиновую кислоту, краситель индиго, аминокислоты, антибиотики, мономерные единицы различных биополимеров. Общая стратегия при этом состоит во введении в организм хозяина специфических генов, клонированных в подходящем векторе, которые кодируют один или несколько ферментов, катализирующих не свойственные микроорганизму метаболические реакции или влияющих на осуществляемый им в норме биосинтез определенных соединений. По имеющимся данным, создание новых метаболических путей не является технически неосуществимым. Этот подход поможет создать необычные, более эффективные пути синтеза самых разных соединений.
ЛИТЕРАТУРА
Anderson S., С. В. Marks, R. Lazarus, J. Miller, К. Stafford, J. Seymour, D. Light, W.Rastetter, D. Estell.1985. Production of 2-keto-L-gulonate, an intermediate in L-ascorbate synthesis by a genetically modified Erwtnta herbicola. Science230: 144-149.
Bailey L E.1991. Toward a science of metabolic engineering. Science252: 1668-1675.
BerryA. 1996. Improving production of aromatic compounds in Escherichia colt by metabolic engineering. Trends Biotechnol, 14:250-256.
Brooks J. E., F. D. Nathan, D. Landry, L. А.Sznyter, P. Waite-Ress, C. L. Ives, L. S. Moran, B. E. Slatko, J. E. Benner.1991. Characterization of the cloned Bamiil restriction modification sys-
tem: Its nucleotide sequence, properties of the methylase, and expression in heterologous hosts. Nucleic Acids Rex. 19:Я41-850.
Cohen C., D. Shiftman, M. Mcvarcch, V. Aharonowitz.1990. Microbial isopenicillin N synthase genes: structure, function, diversity and evolution. Trends Biotechnol. 8: 105—111.
della-Cioppa G., S. J. Ganger, G. G. Sverlow, T. H. Turpen, L. K. Grill.1990. Melanin production in Escherichia coli from a cloned tyrosinase gene. Bio/Technology 8: 634-638.
Ensley B. D., B. J. Ratzkin, T. D. Osslund, M. J. Simon, L. P. Wackelt, D. T.Gibson. 1983. Expression of naphthalene oxidation genes in Escherichia coli results in the biosynthesis of indigo. Science 222: 167-169.
FloresN., J.Xiao, A. Berry, F. Bolivar, F. Vallc.19%. Pathway engineering for the production of aromatic compounds in Escherichia colt. Nat. Biotechnol. 14:620-623.
Floss H. G. 1987. Hybrid antibiotics—the contribution of the new gene combinations. Trends Biotechnol. 5: 111-115.
Fu J.-F., Y.-H. Tseng. 1990. Construction of lactose-utilizing Xanthomonas campestris and pro-uiiidor. of >.u.ih.4; £.nr;: iVom whey, Лр;>;. Environ. MicrobioL 56:919-923.
|
из
5.00
|
Обсуждение в статье: Andio R., D. Silvera, S. D. Suggett, P. L. Achacoso, 3 страница |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

