 |
Главная |
Persing D. H., T. F. Smith, F. C. Tenover, T. J. White
|
из
5.00
|
(ed.). 1993. Diagnostic Molecular Microbiology: Principles and Applications. Ametican Society for Microbiology, Washington, D.C.
Plikaytis В. В., R. H. Gelber, T.M. Shinnick. 1990. Rapid and sensitive detection of Mycohacterium leprae using a nested-prime r gene amplification assay. /. Clin. Microbiol. 28: 1913-1917.
Pollard-Knigth D., A. C.Simmonds, A. P. Schaap, H. Akhavan, M. A. W. Brady.1990. Nonradio-active DNA detection on Southern blots by en/y-matically triggered chemiluminescence. Anal. Biochem. 185:353-358.
Etafalski J. A., S. V. Tingey.1993. Genetic diagnostics in plant breeding: RAPDs, microsatellites and machines. Trends Genet. 9: 275-279.
Saiki R. K., P. S, Walsh, C. H. Levenson, H. A. Fjlich.1989. Genetic analysis of amplified DNA with immobilized sequence-specific oligonucleotide probes. Proc. Nail. Acad. Sei. USA 86:6230-6234.
Sayler G.S., A. C. Layton.1990. Environmental application of nucleic acid hybridization. Anna. Rev, Microbiol. 44:625-648.
Tyagi S., F.R. Κramer. 1996. Molecular beacons: probes that fluorescence upon hybridization. Nat. Bwtechnol. 14:303-308.
Waldmann T. A. 1991. Monoclonal antibodies in diagnosis and therapy. Science 252: 1657—1662.
Weiss J. B.1995. DNA probes and PCR for diagnosis of parasitic infections. Clin. Microbiol. Rev. 8: 113-130.
White T. J., N. Arnheim, H. A. Erlich.1989. The polymerase chain reaction. Trends Genet. 5: 18;:.--L8S
White T. J., R. Made], D. H. Persuig.1992. The polymerase chain reaction: clinical applications. Adv. Clin, Chem. 29: 161-196.
Winter G., C.Milstein. 1991. Man-made antibodies. Nature 349:293-299.
Vu K. F., A. Van Deynze, K. P. Pauls.1993. Random amplified polymorphic DNA (RAPD) analysis, p. 287-301. In B.R. Click and J.E. Thompson (ed.). Methods in Plant Molecular Biology and Biotechnology. CRC Press, Boca Raton, Fla,
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Кратко опишите, как с помощью ПЦР можно выявить изменения в гене ß-глобина человека, приводящие к серповидноклеточной анемии.
2. Изложите принцип метода ПЦР/ЛОЗ.
3. Что такое метод EL1SA?
4. Опишите три способа нерадиоактивного мечения ДНК. Каковы преимущества нерадиоактивных методов детекции?
5. Перед вами стоит задача разработать простой, чувствительный и воспроизводимый тест для обнаружения содержащего двухцепочечную ДНК вируса, вызывающего летальную инфекцию у крупного рогатого скота. Поскольку эффективность лечения зависит от ранней и точной диагностики заболевания, необходимо использовать методы, позволяющие выявлять вирус при его минимальном содержании в организме инфицированного животного, еще до появления каких-либо симптомов заболевания. Кратко опишите и обоснуйте последовательность ваших действий.
6. Что означают чувствительность, специфичность и простота применительно к диагностическим тестам?
7. Как в настоящее время диагностируют болезнь Чагаса? Каким образом можно усовершенствовать существующую процедуру?
8. Почему использование флуоресцентных красителей облегчает обнаружение специфических нуклеотидных последовательностей?
9. Что такое зонд — «молекулярный маяк» и как он действует?
10. Что такое геномная дактилоскопия и как ее используют для характеристики следовых количеств ДНК в судебной медицине?
11. Что представляет собой метод RAPD и как его используют для выявления генетических вариантов растительных культур?
ГЛАВА 10.
Микробиологическое производство лекарственных средств
До появления технологии рекомбинантных ДНК многие лекарственные препараты на основе белков человека удавалось получать только в небольших количествах, их производство обходилось очень дорого, а механизм биологического действия иногда был недостаточно изучен. Предполагалось, что с помощью новой технологии можно будет получать весь спектр таких препаратов в количествах, достаточных как для их эффективного тестирования, так и для применения в клинике. И эти ожидания оправдались. На сегодняшний день клонировано более 400 генов (в основном в виде кДНК) различных белков человека, которые в принципе могут стать лекарственными препаратами. Большинство этих генов уже экспрессированы в клетках-хозяевах, и сейчас их продукты проходят проверку на возможность применения для лечения различных заболеваний человека (табл. 10.1). Впрочем, хотя более 30 таких биотехнологических препаратов и получило одобрение в США (табл. 10,2), пройдет еще несколько лет, прежде чем они будут рекомендованы для широкого использования и поступят в продажу; вначале их подвергнут проверке на животных и проведут тщательные клинические испытания. Однако фармацевтические фирмы уже сейчас проявляют к ним интерес. По подсчетам специалистов, ежегодный объем мирового рынка лекарственных препаратов на основе белков человека составляет около 150 млрд. долларов и постоянно растет. Объем мирового рынка лекарственных средств на основе рекомбинантных белков увеличивается на 12—14% в год и к 2000 г. составит примерно 20 млрд. долларов.
Разработка новых методов профилактики и лечения многих заболеваний человека внесла огромный вклад в рост благосостояния людей в XX в, Однако этот процесс никогда нельзя считать завершенным. Так называемые «старые» заболевания (например, туберкулез) могут дать о себе знать вновь, как только будут ослаблены профилактические меры или появятся резистентные штаммы. Весьма привлекательной выглядит перспектива применения в качестве терапевтических средств специфических антител; их можно будет использовать для нейтрализации токсинов, борьбы с бактериями, вирусами, для лечения раковых заболеваний. Антитело можно уподобить самонаводящейся ракете, которая либо нейтрализует «нарушителя» — чужеродный агент, либо, если она оснащена «боеголовкой», разрушает специфическую клетку-мишень. К сожалению, несмотря на многообещающие возможности, антитела довольно редко применялись для профилактики и лечения болезней и других патологий. И лишь в последнее время, с развитием технологии рекомбинантных ДНК и разработкой методов получения моноклональных антител и с расшифровкой молекулярной структуры и функции иммуноглобулинов, интерес к применению специфических антител для лечения различных заболеваний вновь пробудился.
Лекарственные препараты
Выделение кДНК интерферонов
Для выделения генов или кДНК белков человека используют разные подходы. В ряде случаев выделяют нужный белок и определяют аминокислотную последовательность соответствую-
Микробиологическое производство лекарственных средств 205
| Таблица 10.1. Некоторые белки человека, полученные генно инженерны ми методами | |
| Белок | Заболевание/Физиологический процесс |
| Адренокортикотропный гормон | Ревматизм |
| а, - Антитрипсин | Эмфизема |
| Бактерицидный/повышающий проницаемость белок | Различные инфекции |
| Гемоглобин | Анемия |
| Гормон роста (соматотропин) | Задержка роста |
| Инсулин | Сахарный диабет |
| Инсулиноподобный фактор роста | Сахарный диабет, почечная недостаточность |
| Интерлейкины | Злокачественное новообразование, иммунные заболевания |
| Интерфероны (α, β, γ) | Вирусные заболевания, злокачественное новообразование, |
| рассеянный склероз | |
| Кальцитонин | Остеомаляция |
| Лимфотоксин | Злокачественное новообразование |
| Нейротропный фактор, вырабатываемый в мозге | Боковой амиотрофическиЙ склероз |
| Релаксин | Роды |
| Рецептор интерлейкина- 1 | Астма, ревматоидный артрит |
| Соматолиберин | Задержка роста |
| Соматомедин С | Задержка роста |
| Сывороточный альбумин | Дефицит белков плазмы |
| Тиреотропный гормон | Рак щитовидной железы |
| Тканевой активатор плазминогена | Тромбообразование |
| Тромбоцитарный фактор роста | Атеросклероз |
| Урогастрон | Язвы |
| Уроки наза | Тромбообразование |
| Фактор, активирующий макрофаги | Злокачественное новообразование |
| Фактор некроза опухоли | Злокачественное новообразование |
| Фактор роста нервов | Повреждение нервной ткани |
| Фактор роста эпидермиса | Ожоги |
| Фактор VIII | Гемофилия |
| Фактор IX | Гемофилия |
| Факторы роста В-лимфоцитов | Иммунные заболевания |
| Колониестимулирующие факторы | Злокачественные новообразования |
| Хорионический гонадотропин | Женское бесплодие |
| Эндорфины и энкефалины | Боль |
| Эритропоэтин | Анемия, заболевания почек |
щего участка молекулы. Исходя из этого находят кодирующую его нуклеотидную последовательность, синтезируют соответствующий олигонуклеотид и используют его в качестве гибридиза-ционного зонда для выделения нужного гена или кДНК из геномных или кДНК-библиотек. Другой подход состоит в выработке антител к очищенному белку и использовании их для скрининга библиотек, в которых происходит экспрессия определенных генов. Для белков человека, синтезируемых преимущественно в какой-то одной ткани, кДНК-библиотека, полученная на основе мРНК, выделенной из этой ткани, будет обогащена последовательностью ДНК-мишени. Например, основным белком, синтезируемым клетками островков Лангерганса поджелудочной железы, является инсулин, и 70% мРНК, выделенных из этих клеток, кодируют именно его. Однако принцип обогащения кДНК неприменим для тех белков человека, количество которых очень мало или место синтеза которых неизвестно. В этом случае могут понадобиться другие экспериментальные подходы. Интерфероны (ИФ) человека, включающие α-, β- и γ-интерфероны (ИФα, ΗΦβ, ИФγ), — это природные белки, каждый из которых может найти свое терапевтическое применение (табл. 10.3), При выделении их кДНК пришлось разработать новый подход, позволяющий преодолеть трудности, связанные с недостаточным содержани-
206 ГЛАВА 10
| Таблица 10.2. Некоторые рекомбинантные белки, получившие разрешение Департамента по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) на применение для лечения заболеваний человека | ||
| Белок | Фирма | Заболевание |
| Антигемофильный фактор | M ilex, Baxter Healthcare, | Гемофилия А |
| Genetics Institute | ||
| Глюкоцереброзидазa | Genzynie | Болезнь Гоше |
| Гормон роста | Cenentech | Дефицит гормона роста у детей |
| ДНКаза I | Genentech | Муковисцидоз |
| Инсулин | Eli Lilly | Сахарный диабет |
| Интерлейкин-2 | Chiron | Рак почки |
| ИФa2а | Hoffmann- La Roche | Волосистая лейкоплакия, саркома Капоши |
| ИФa2b | Schering-Plough | Волосистая лейкоплакия, остроконечная кондилома, саркома Капоши, гепатиты В и С |
| ИФan3 | Interferon Sciences | Остроконечная кондилома |
| ИФβ1b | Berlex Laboratories and Chiron | Рецидивирующий рассеянный склероз |
| ИФγ1b | Genentech | Хронический гранулематоз |
| Соматотропин | Eli Lilly | Дефицит гормона роста |
| Тканевой активатор плазминогена | Genentech | Острый инфаркт миокарда, острая обширная эмболия легочной артерии |
| Эритропоэтин | Amgen and Ortho Biotech | Анемия, заболевания почек |
ем соответствующих мРН К и белков. Процедура выделения кДНК интерферонов состояла в следующем.
1. Из лейкоцитов человека выделили мРНК и фракционировали ее по размерам; провели обратную транскрипцию и встроили в сайт PstIплазмиды pBR322.
2. Полученным продуктом трансформировали Escherichia coli. Образовавшиеся 6000 клонов подразделили на 12 групп; по 512 клонов в каждой. Тестирования проводили на группе клонов, что позволило ускорить процесс их идентификации.
3. Каждую группу клонов гибридизовали с неочищенным препаратом ИФ-мРНК,
4. Из образовавшихся гибридов, содержащих клонированную ДНК и мРНК, выделили мРНК и провели ее трансляцию в бесклеточной системе синтеза белка.
5. Определили интерферонную противовирусную активность каждой смеси, полученной в результате трансляции. Группы, проявившие интерферонную активность, содержали клон с кДНК, гибридизовшейся с ИФ-мРНК.
6. Позитивные группы разбили на 8 подгрупп, содержащих по 64 клона, и вновь провели тестирование. Разбиение на подгруппы повторяли до тех пор, пока не идентифицировали клон, содержащий полноразмерную ИФ-кДНК человека.
Если нужно получить большие количества ИФ, соответствующую кДНК можно субклонировать в экспрессирующем Е. соli-векторе, который позволяет достичь высокого уровня экспрессии.
| Таблица 10,3. Возможное терапевтическое применение некоторых интерферонов человека | |
| Интерферон a2а | Заболевание |
| Гепатит С, волосистая лейкоплакия | |
| a2b | Рак мочевого пузыря, рак головы и шеи, злокачественная меланома. |
| множественные миеломы, неходжкинская лимфома, рак почки, болезнь Крона, ВИЧ-инфекция | |
| an3 | СПИД, цервикальная дисплазия, папилломавирусные инфекции, хронический гепатит С, остроконечная кондилома |
| β1a β1b | Рассеянный склероз Хронический прогрессирующий рассеянный склероз |
| γ1b | Рак почки, хронический гранулематоз |
Микробиологическое производство лекарственных средств 207
Интерфероны человека, полученные методом генной инженерии
Первый ген интерферона был выделен в начале 80-х гг. С тех пор было обнаружено несколько разных интерферонов. Как мы уже говорили, исходя из химических и биологических свойств всех их можно подразделить на три группы: ИФα, ИΦβ и ИФγ. ИФα и ИΦβ синтезируются клетками, обработанными препаратами вирусов или вирусной РНК, а ИФγ вырабатывается в ответ на действие веществ, стимулирующих рост клеток. ИФα кодируется семейством генов, включающим как минимум 15 неаллельных генов, в то время как ИΦβ и ИФγ колируются одним геном каждый. Подтипы ИФαпроявляют разную специфичность. Например, при проверке эффективности ИФα1 и ИФα2 на обработанной вирусом линии клеток быка эти интерфероны проявляют сходную противовирусную активность, в случае же обработанных вирусом клеток человека ИФα2 оказывается в семь раз активнее, чем ИФα1. Если противовирусная активность проверяется на клетках мыши, то ИФα2 оказывается в 30 раз менее эффективным, чем ИФα1.
Было предпринято несколько попыток создать ИФ с комбинированными свойствами, используя тот факт, что члены семейства ИФα различаются по степени и специфичности своей противовирусной активности. Теоретически этого можно достичь, соединив части последовательностей генов разных ИФα. Это приведет к образованию гибридного белка с другими свойствами, чем у каждого из исходных белков. Сравнение последовательностей кДНК ИФα1 и ИФα2 показало, что они содержат одинаковые сайты рестрикции в позициях 60, 92 и 150. После расщепления обеих кДНК в этих сайтах и последующего лигирования фрагментов было получено несколько гибридных генов (рис. 10.1). Эти гены экспрессировали в Е. coli, синтезированные белки очистили и исследовали их биологические функции. Проверка защитных свойств гибридных ИΦ на культуре клеток млекопитающих показала, что некоторые из них проявляют большую активность, чем родительские молекулы. Кроме того, многие гибридные ИФ индуцировали образование 2'—5'-олигоизоаденилат-синтетазы в контрольных клетках. Этот фермент участвует в синтезе 2'—5'-связанных олигонуклеотидов, которые в свою очередь активируют латентную клеточную эндорибонуклеазу, расщепляющую вирусную мРНК. Другие гибридные ИФ проявляли большую, чем родительские молекулы, антипролиферативную активность в культурах различных раковых клеток человека.
| Рис. 10.1. Структура генов ИФa2, ИФa3 и четырех гибридных генов. Сравнение нуклеотидных последовательностей генов ИФa2 и ИФa3 обнаруживает наличие у них одинаковых сайтов для рестрицирующих эндонуклеаз (RE1, RE2, RE3). Рестрикция по этим сайтам и лигирование полученных фрагментов приводят к образованию различных гибридных генов. В нижней части рисунка представлены четыре из них. | 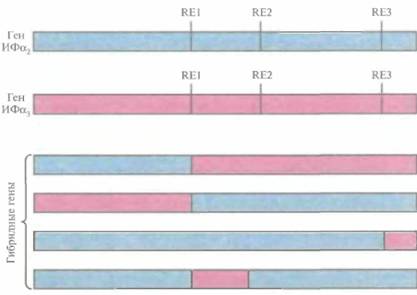
|
208ГЛАВА 10
Гормон роста человека, полученный методом генной инженерии
Стратегию конструирования новых белков путем замены функциональных доменов или с помощью направленного мутагенеза можно использовать для усиления или ослабления биологического действия белка. Например, нативный гормон роста человека (ГРЧ) связывается в разных типах клеток как с рецептором гормона роста, так и с пролактиновым рецептором.
Чтобы избежать нежелательных побочных эффектов в процессе лечения, нужно исключить присоединение ГРЧ к пролактиновому рецептору. Поскольку участок молекулы гормона роста, связывающийся с этим рецептором, по своей аминокислотной последовательности лишь частично совпадает с участком молекулы, который взаимодействует с пролактиновым рецептором, удалось избирательно снизить связывание гормона с последним. Для этого использовали сайт-специфический мутагенез, в результате которого произошли определенные изменения в боковых группах некоторых аминокислот (His-18, His-21 и Glu-174) — лигандов для ионов Zn2+, необходимых для высокоаффинного связывания ГРЧ с пролакгиновым рецептором (рис. 10.2). Модифицированный гормон роста связывается только со «своим» рецептором. Полученные результаты представляют несомненный интерес, но смогут ли модифицированные ГРЧ найти применение в клинике, пока неясно.
Оптимизация генной экспрессии
Недостаточно создать новый белок, важно оптимизировать экспрессию его гена. Для начала исследователи определяют возможность синтеза достаточных количеств аутентичного белка в прокариотической или эукариотической системах экспрессии. Прокариотическим системам отдается предпочтение, поскольку работа с ними обходится дешевле, а производительность выше. К сожалению, не все микроорганизмы синтезируют функциональные формы гетерологичных белков с одинаковой эффективностью, поэтому необходимо проводить сравнительные количественные оценки.
При изучении экспрессии гена интерлейкина-3 человека в различных клетках-хозяевах «наилучшим» хозяином оказалась Bacillus licheniformis (табл. 10.4). Хотя в одной из систем Е, coli был достигнут несколько более высокий уровень экспрессии, полученный белок мол. массой 20 кДа представлял собой продукт слияния интерлейкина-3 с участком ß-галактозидазы Е. coli, a не зрелый аутентичный белок мол. массой 15 кДа. Как правило, подобный химерный белок нельзя использовать в качестве лекарственного средства. Клетки дрожжей Kluyveromyces lactis и Saccharomyces cerevisiae, а также клетки человека были способны гликозилировать интерлейкин-3, однако уровень экспрессии в них был относительно низок. Гликозилирование не оказывает заметного влияния на активность интерлейкина-3, но ведет к ощутимой разнице в размерах молекулы.
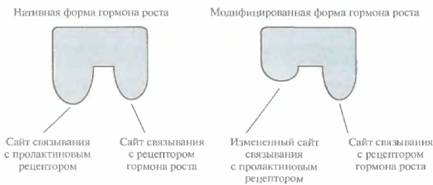
| Рис. 10.2. Схематическое изображение нативной и модифицированной форм гормона роста человека (ГРЧ). С помощью олигонуклеотид-направленного мутагенеза получена форма ГРЧ, утратившая способность связываться с пролактиновым рецептором, но сохранившая специфичность к рецептору гормона роста. |
Микробиологическое производство лекарственных средств 209
| Таблица 10.4. Уровень экспрессии гена интерлейкина-3 в разных системах клеток-хозяев1) | |||
| Клетка-хозяин | Промотор2) | Уровень экспрессии, ЕД | Мол. масса белка, кДа |

| 
| 
| 
|
| 1) Из работы van Leen et al, Bio/Technology 9: 47-52, 1991, с изменениями. 2)В каждом случае использовался один из наиболее сильных промоторов, «работающих» в данной системе. |
Ферменты
ДНКаза I
Наиболее частым летальным наследственным заболеванием среди европеоидов является муковисцидоз. В США выявлено 30 000 случаев этого заболевания, в Канаде и странах Европы - 23 000. Пациенты с муковисцидозом часто страдают инфекционными заболеваниями, поражающими легкие. Лечение рецидивирующих инфекций антибиотиками в конце концов приводит к появлению резистентных штаммов патогенных бактерий. Бактерии и продукты их лизиса вызывают накопление в легких вязкой слизи, затрудняющей дыхание. Одним из компонентов слизи является высокомолекулярная ДНК, которая высвобождается из бактериальных клеток при лизисе. Ученые из биотехнологической компании Genentech (США) выделили и экспрессировали ген ДНКазы — фермента, который расщепляет высокомолекулярную ДНК на более короткие фрагменты. Очищенный фермент вводят в составе аэрозоля в легкие больных муковисцидозом, он расщепляет ДНК, вязкость слизи снижается, что облегчает дыхание. Хотя эти меры и не излечивают муковисцидоз, они облегчают состояние больного. Применение данного фермента было недавно одобрено Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США), и объем его продаж составил в 2000 г. примерно 100 млн. долларов.
Альгинат-лиаза
Альгинат - это полисахарид, синтезируемый целым рядом морских водорослей, а также почвенными и морскими бактериями. Его мономерными единицами являются два сахарида – ß-D-маннуронат и a-L-гулуронат, относительное содержание и распределение которых и определяют свойства конкретного альгината. Так, остатки a-L-гулуроната образуют межцепочечные и внутрицепочечные сшивки путем связывания ионов кальция; остатки ß-D-маннуроната связывают ионы других металлов, Альгинат, содержащий такие сшивки, образует эластичный гель, вязкость которого прямо пропорциональна размеру полисахаридных молекул.
Выделение альгината слизистыми штаммами Pseudomonas aemginosa существенно повышает вязкость слизи у больных муковисцидозом. Чтобы очистить дыхательные пути и облегчить состояние больных, в дополнение к обработке ДНКазой I следует провести деполимеризацию альгината с помощью альгинат-лиазы.
Ген альгинат-лиазы был выделен из Flavobacterium sp., грамотрицательной почвенной бактерии, ативно вырабатывающей этот фермент. На основе E. coli был создан банк клонов Flavobacterium и проведен скрининг тех из них, которые синтезируют альгинат-лиазу, путем высевания всех клонов на твердую среду, содержащую альгинат, с добавлением ионов кальция. В таких условиях весь альгинат, находящийся в среде, за исключением того, который окружает продуцирующие альгинат-лиазу колонии, образует сшивки и становится мутным. Гидролизованный альгинат теряет способность к формированию сшивок, поэтому среда вокруг синтезирующих альгинатлиазу колоний остается прозрачной-Анализ клонированного фрагмента ДНК, присутствующего в одной из положительных колоний, показал наличие открытой рамки считывания, кодирующей полипептид мол. массой около 69 000. Более детальные биохимические и
210 ГЛАВА 10
|
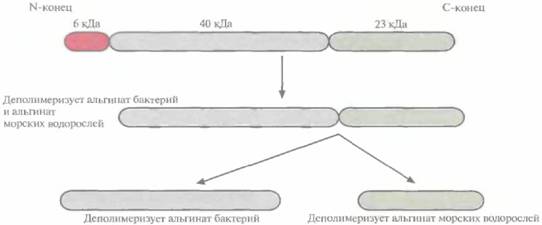
| Рис. 10.3. Процессинг белка — предшественника рекомбинантной альгинат-лиазы Flavobacterium, происходящий в Е. coli. В результате отщепления от белка мол. массой 69 кДа пептида 6 кДа образуется белок мол. массой 63 кДа, способный деполимеризовать альгинат морских водорослей и бактериальный альгинат. Расщепление белка 63 кДа дает белок мол. массой 23 кДа, активно деполимеризующий альгинат морских водорослей, и белок мол. массой 40 кДа, гидролизу ющий бактериальный альгинат. |
генетические исследования показали, что этот полипептид, по-видимому, является предшественником трех альгинат-лиаз, вырабатываемых Flavobacterium sp. (рис. 10.3). Сначала какой-то протеолитический фермент отрезает от него N-концевой пептид массой около 6000. Оставшийся белок мол. массой 63 000 способен деполимеризовать альгинат, вырабатываемый как бактериями, так и морскими водорослями. При его последующем разрезании образуется продукт мол. массой 23 000, деполимеризующий альгинат морских водорослей, и фермент мол. массой 40 000, разрушающий альгинат бактерий. Для получения больших количеств фермента мол. массой 40 000 кодирующую его ДНК амплифицировали методом полимеразной цепной реакции (ПЦР), а затем встраивали в выделенный из В. subtilis плазмидный вектор, несущий ген, кодируюший сигнальный пептид α-амилазы В. sitbtüis. Транскрипцию контролировали при помощи системы экспрессии гена пенициллиназы (рис. 10.4). При
трансформации клеток В. subtilis полученной плазмидой и высевании их на содержащую альгинат твердую среду с добавлением ионов кальция образовались колонии с большим ореолом. Когда такие колонии выращивали в жидкой среде, ре-комбинантная альгинат-лиаза выделялась в культуральную среду. Последующие тесты показали, что этот фермент способен эффективно разжижать альгинаты, синтезируемые слизистыми штаммами P. aeruginosa, которые были выделены из легких больных муковисцидозом. Для того чтобы определить, целесообразно ли проводить клиническое тестирование рекомбинантной альгинат-лиазы, нужны дополнительные исследования.
Моноклональные антитела как лекарственные средства
Примерно 100 лет назад была предпринята попытка лечения детей, больных дифтерией, с помощью неочищенной антисыворотки, получен-

|
| Рис. 10.4. ДНК, кодирующая альгинат-лиазу мол. массой 40 кДа. К последовательности, кодирующей N-конец альгинат-лиазы, присоединен сегмент гена α-амилазы В. subtilis, кодирующий ее сигнальный пептид. Транскрипция контролируется при помощи системы экспрессии гена пенициллиназы В. subtilis. |
Микробиологическое производство лекарственных средств 211
ной от лошадей, которых инфицировали Corynebacierium diphtheriae, вызывающей дифтерию у человека. С. diphtheriae инфицирует горло и миндалины, выделяя экзотоксин, приводящий к гибели клеток человека. Проникая в кровоток, этот токсин поражает органы, удаленные от места первичной инфекции, и в отсутствие лечения болезнь может иметь летальный исход. (В те времена, о которых идет речь, смертность достигала 45%.) Однако, если больному в первые несколько дней после начала инфекции ввести лошадиную антисыворотку, содержащую антитела к этому экзотоксину, то у него возникнет пассивный иммунитет, который позволяет избежать летального исхода.
К сожалению, риск, связанный с использованием антител, не позволяет широко применять этот метод терапии. Дело в том, что в организме больного часто вырабатываются собственные антитела на чужеродные белки, присутствующие в цельной или частично очищенной антисыворотке, и ее повторное введение в случае сенсибилизации организма может привести к развитию анафилактического шока и гибели пациента.
С развитием гибридомной технологам вновь появилась надежда на то, что антитела можно будет использовать в качестве терапевтических средств для поддержания постоянного уровня чистых моноспецифичных антител в организме. Однако остаются проблемы, связанные с риском развития перекрестных реакций, приводящих к развитию иммунного ответа и анафилаксии: ведь в организме бального могут вырабатываться собственные антитела на детерминанты монокло-нальных антител мыши. Поэтому основная задача в настоящее время состоит в том, чтобы разработать методы получения моноклональных антител человека, обладающих как специфическими иммунотерапевтическими свойствами, так и пониженной иммуногенностью.
Структура и функции антител
Молекула антитела (иммуноглобулин) состоит из двух «легких» (L) и двух «тяжелых» (Н) белковых цепей, которые соединены водородными связями и расположенными в строго определенных местах дисульфидными мостиками. N-концевые участки L- и Η-цепей образуют антигенсвязывающий сайт. Отдельные домены
(области) молекулы антитела выполняют разные функции, что облегчает манипуляции с генами антител (рис. 10.5). Антигенсвязывающие сайты состоят из трех участков, определяющих комплементарность антител к антигену (CDR, от англ, complementarity-determining regions), и образующих вариабельные (VH и Vl) области на N-концах Н- и L-цепей. Для CDR характерна очень высокая изменчивость последовательности аминокислот, поэтому их еще называют гипервариабельными. Помимо вариабельных (VH и Vl), каждая L-цепь содержит одну константную область, или домен (CL), a каждая Η-цепь -три константных области, или домена (СH1, СН2 и СH3). При обработке антитела протеолитическим ферментом папаином образуются три фрагмента: два идентичных (Fab), каждый из которых содержит интактную L-цепь, связанную дисульфидным мостиком с vh- и СH1-доменами Н-цепи, и один Fc, состоящий из двух соединенных дисульфидной связью СН2- и Сн3-доменов Н-цепи, Fab-фрагмент, точнее его N-концевая часть, называемая Fv-фрагментом, обладает антигенсвязывающей активностью, присущей интактной молекуле антитела (рис. 10.5). При этом его аминокислотная последовательность у разных молекул существенно различается.
После связывания антигена с интактным антителом запускаются следующие реакции иммунного ответа.
• Активируется система комплемента. Компоненты этой системы разрушают клеточные мембраны, активируют фагоциты и генерируют сигналы, мобилизующие другие компоненты системы иммунного ответа.
• В результате связывания Fc-участка антитела с Fc-рецептором эффекторной клетки запускается реакция опосредованной антителами клеточной цитотоксичности. Активированная эффекторная клетка высвобождает вещества, лизирующие чужеродную клетку, с которой связан Fab-участок молекулы антитела.
• После связывания Fab-участка с растворимым антигеном Fc-участок антитела может присоединяться к Fc-рецепторам фагоцитов, которые захватывают и разрушают комплекс антиген—антитело.
212ГЛАВА 10
Профилактика отторжения трансплантированных органов
В 1970-х гг. были пересмотрены взгляды на пассивную иммунизацию: ее стали считать профилактическим средством борьбы с отторжением трансплантированных органов. Предлагалось вводить пациентам специфические антитела, которые будут связываться с лимфоцитами определенного типа, уменьшая иммунный ответ, направленный против пересаженного органа.
Первыми веществами, рекомендованными Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) для использования в качестве иммуносупрессоров при пересадке органов у человека, были моноклональные антитела мыши ОКТЗ. За отторжение органов отвечают так называемые Т-клетки — лимфоциты, дифференцирующиеся в тимусе. ОКТЗ связываются с рецептором, находящимся на поверхности любой Т-клетки, который называется CD3. Это предупреждает развитие полного иммунного ответа и отторжение трансплантированного органа. Подобная иммуносупрессия весьма эффективна, хотя и оказывает некоторые побочные действия, например вызывает лихорадку и приводит к появлению сыпи.
Лекарственные вещества, связанные с моноклональными антителами
Лекарственные вещества, проявляющие высокую ахтивность при тестировании in vitro (обычно в культуре клеток), зачастую оказываются значительно менее эффективными in vivo. Кажущееся снижение их активности объясняется тем, что они не достигают органа или клетки-мишени в нужной концентрации. Увеличение дозы принимаемого препарата не решает проблему, поскольку при этом часто возникают побочные эффекты. Более того, чтобы избежать таких эффектов, многие терапевтические средства заведомо вводят в дозах, не достигающих оптимальных, что дополнительно снижает их эффективность. Для облегчения доставки лекарственного вещества к месту его действия используют несколько приемов. 1. Заключают его в особые частицы — липосомы, липидная обо-
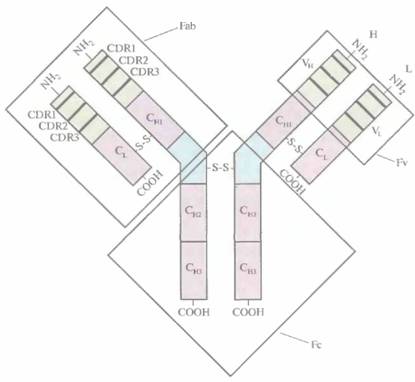
| Рис. 10.5. Строение молекулы антитела. Н- и L-цепи состоят из вариабельных (VH и VL ) и константных (CL, CH1, СН2 и СH3) доменов. Вариабельные домены содержат СDR- участки (CDR1, CDR2 и CDR3). |
Микробиологическое производство лекарственныхсредств 213
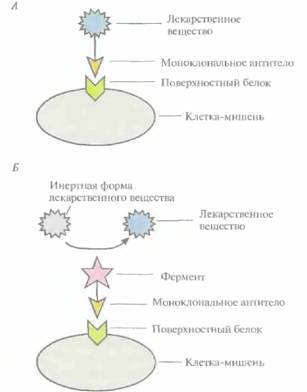
лочка которых имеет высокое сродство к нужным органам. 2. Встраивают гены специфических токсинов в инфильтрирующие опухоль лимфоциты, которые высвобождают эти токсины непосредственно в опухоли. 3. Присоединяют молекулы лекарственных веществ к моноклональным антителам, специфичным по отношению к белкам, находящимся на поверхности строго определенных клеток, например опухолевых (рис. 10.6). 4. Используют лекарственные вещества в неактивной форме, переводя их в активное состояние при помощи ферментов. Чтобы такое превращение происходило только вблизи клетки-мишени, фермент присоединяют к моноклональному антителу, специфичному к поверхностному антигену этой клетки (рис. 10.6).
Для эффективной работы последней из описанных систем необходимо, чтобы а) моноклональное антитело, связанное с ферментом, переводящим лекарственное вещество в активную форму, было в достаточной степени очищено и имелось в нужном количестве; б) связывалось с высокоспецифичным для клетки-мишени белком; в) было стабильным в физиологических условиях, но в то же время быстро выводилось из кровотока; 2) при необходимости могло проникать в опухолевую ткань, обеспечивая действие препарата на все ее клетки. В этом случае мишенями оказываются строго определенные клетки, что позволяет использовать лекарственное вещество в гораздо меньших дозах, чем при прямом введении. Применение в такой системе моноклональных антител мыши может приводить к развитию иммунного ответа, поэтому очень важно использовать фрагменты антител человека или антител, максимально сходных с ними по структуре.
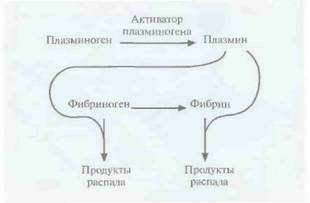
Наиболее частой причиной смерти в странах Северной Америки и Европы является тромбоэмболия мозговых или сердечных артерий. Тромб состоит из молекул фибрина, фактора свертывающей системы крови, образующего сеть в ответ на повреждение сосудистой стенки. E норме молекулы фибрина в образовавшемся тромбе расщепляются с помошью плазмина сериновой протеиназы, который образуется из плазминогена под действием активатора (рис, 10.7), Однако нередко эта биологическая
|
| Рис. 10.6. Схематическое изображение системы целевой доставки лекарственного вещества, основанной на использовании моноклональных антител. А. Молекула лекарственного вещества присоединена к моноклональному антителу. Б. Кмоноклональному антителу присоединен фермент, превращающий инертную форму лекарственного вещества в активную только в непосредственной близости от клетки-мишени. В обоих случаях моноклональное антитело связывается с одним специфическим белком на поверхности клетки -мишени. |
система работает недостаточно эффективно, что приводит к закупорке артерий. В таких ситуациях для повышения уровня плазмина в крови было предложено использовать активатор плазминогена в качестве терапевтического средства.
Однако плазмин способен разрушать и предшественник фибрина фибриноген (рис, 10.7), и если уровень последнего в результате терапии с использованием активатора плазминогена снизится слишком сильно, могут произойти обширные внутренние кровотечения. Это привело к необходимости создания тромболитических препаратов, разрушающих только фибрин в
214 ГЛАВА 10
| |||||||||
Рис. 10.7. Активация плазмино
Популярное: Организация как механизм и форма жизни коллектива: Организация не сможет достичь поставленных целей без соответствующей внутренней... Почему стероиды повышают давление?: Основных причин три... Почему двоичная система счисления так распространена?: Каждая цифра должна быть как-то представлена на физическом носителе... Почему люди поддаются рекламе?: Только не надо искать ответы в качестве или количестве рекламы...  ©2015-2024 megaobuchalka.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. (480)
|
Почему 1285321 студент выбрали МегаОбучалку... Система поиска информации Мобильная версия сайта Удобная навигация Нет шокирующей рекламы |
(0.012 сек.)

