 |
Главная |
Спектроскопия в УФ- и видимом диапазонах
|
из
5.00
|
Приборы для фиксации оптических спектров построены по единому принципу. В качестве источника УФ излучения обычно применяется "водородная лампа" (электрический разряд в атмосфере водорода при низком давлении), которая дает практически непрерывный спектр излучения в области 190-360 нм.
Для работы в видимой области служит лампа накаливания с вольфрамовой спиралью. Излучение от источника попадает в монохроматор, состоящий из зеркала, кварцевой призмы и щели. Отражаясь от зеркала, свет разлагается призмой или дифракционные решетки и затем с помощью щели из спектра выделяется узкая область. При вращении призмы спектр перемещается по отношению к щели, что позволяет получать лучи света со строго определенной длиной волны, обычно с точностью ±0,5 нм. Монохроматическое излучение пропускается через кварцевую кювету, содержащую раствор исследуемого вещества в прозрачном для УФ- области растворителе. Толщина кювет 1-10 см, наиболее распространенные кюветы имеют сечение 1´1 см, и для их заполнения требуется около 3 мл раствора. Интенсивность прошедшего через кювету света измеряется с помощью фотоэлемента, величина тока которого пропорциональна интенсивности падающего света. Ток усиливается и регистрируется потенциометром.
Сравнивается интенсивность светового луча, прошедшего через исследуемый раствор, и луча, пропущенного через аналогичную кювету с чистым растворителем. Получаемая разность соответствует поглощению растворенного исследуемого вещества.
Такое сравнение может быть проведено двумя путями. При наличии одного светового луча на его пути попеременно ставят кювету с исследуемым раствором и с растворителем (кювету сравнения). Спектр строят по точкам, постепенно вручную настраивая прибор на определенные длины волн. В современных регистрирующих приборах световой поток делится на два одинаковых пучка, один из которых проходит через исследуемый раствор, а другой - через растворитель, причем как сравнение интенсивностей прошедших через кюветы световых потоков, так и непрерывное изменение длин волн производится автоматически. В том и другом случае получают спектр вещества, представляющий собой зависимость оптической плотности раствора (D) от длины волны поглощаемого света:

В точках максимумов молярный коэффициент погашения вычисляют по формуле

Спектр в большинстве случаев представляет собой кривую с одним пологим максимумом. Большая ширина полосы поглощения обусловлена тем, что помимо основных уровней электронных переходов существуют подуровни, связанные с колебаниями молекулы. Многочисленность таких подуровней обычно приводит к тому, что соответствующие им отдельные максимумы сливаются в один, имеющий пологую форму. В отдельных случаях, например для ароматических соединений, за счет колебательных подуровней максимум поглощения представляет собой набор узких полос по обе стороны от основной. В таких случаях принято говорить, что максимум имеет тонкую структуру.
Приборы различных схем позволяют получать спектры в различных областях спектра. В УФ области поглощают все органические вещества. Длины волн менее 190 нм (дальняя, или вакуумная область УФ спектра) малопригодны для работы, так как в этой области поглощают компоненты воздуха - кислород и азот. Приборы для исследований в интервале длин волн 120-190 нм с вакуумными камерами существуют, однако они сложны и редко используются в обычной лабораторной практике; существуют схемы, где влияние газов воздуха ликвидируют продувкой полостей, по которым проходит луч непоглощающим газом.
Для волн длиной более 200 нм воздух прозрачен, что делает ближнюю ультрафиолетовую и видимую области спектра (190-800 нм) удобными для измерений. В том же интервале прозрачен кварц, который в УФ спектроскопии применяется как оптический материал для изготовления призм и кювет. Приборы для получения спектров поглощения в этой области просты и доступны. Необходимые для исследования количества вещества невелики - около 0,1 мг. В связи с этим УФ спектроскопия в настоящее время является одним из наиболее распространенных физико-химических методов исследования органических соединений.
Поглощение органическими веществами электромагнитных колебаний в ультрафиолетовой (УФ) и видимой области обусловлено переходом электронов со связывающих орбиталей на разрыхляющие или несвязывающие орбитали; такое состояние молекулы называется возбужденным.
При взаимодействии с квантом света электрон, поглощая энергию, может переходить с высшей заполненной орбитали на низшую вакантную орбиталь. Электроны достаточно прочно удерживаются ядром, поэтому для их возбуждения требуются большие энергии и, следовательно, электромагнитное излучение, имеющее малые длины волн (120 - 800 нм).
Электроны в атомах и молекулах занимают орбитали со строго определенной энергией. Уровень энергии атомных орбиталей определяется соответствующим набором квантовых чисел. Молекулярные орбитали могут рассматриваться как линейные комбинации атомных. Такая комбинация дает связывающую орбиталь (¯, электроны с антипараллельными спинами, нормальное состояние) и разрыхляющую орбиталь (, электроны с параллельными спинами, возбужденное состояние).

В обычных органических молекулах присутствуют электроны s- и p-связей, а также электроны неподеленных пар гетероатомов, или n-электроны. Их относительные энергетические уровни и сравнительные энергии возможных переходов в возбужденное состояние представлены на рис. 4, из которого следует, что наибольшая энергия кванта необходима для осуществления перехода s®s*, т.е. для возбуждения электронов наиболее прочной s-связи необходимы кванты света минимальной длины волны. Энергия переходов n®s* и p®p* меньше, и, следовательно, длина волны света, возбуждающего такой переход, соответственно больше. Энергия n-уровня электронов выше энергии p-уровней, поэтому возбуждение вызывается квантами света еще большей длины волны. Практическое значение имеют переходы n®p* и p®p*, поскольку только им соответствуют длины волн, попадающие в рабочий диапазон прибора. Исключение составляют переходы p®p* изолированных двойных связей С=С и C=N, а также тройных связей 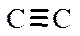 и
и  (lмакс 160-180 нм). Для изолированных кратных связей в используемом для измерений интервале проявляется только переход карбонильной группы С=О (lмакс » 270 нм).
(lмакс 160-180 нм). Для изолированных кратных связей в используемом для измерений интервале проявляется только переход карбонильной группы С=О (lмакс » 270 нм).
Группировки, вызывающие избирательное поглощение электромагнитного колебания в УФ- области, называются хромофорами. Основными хромофорами, дающими максимум поглощения в области 200-800 нм, являются системы сопряженных двойных связей. Орбитали, образуемые двумя сопряженными двойными связями, представлены на рис. 5.

Из рисунка очевидно, что при взаимодействии двух p - орбиталей, соответствующих изолированным двойным связям, образуются две новые орбитали: связующая (p+p) и разрыхляющая (p-p). Возбужденному состоянию также соответствуют две орбитали. Следовательно, для возбуждения электронов сопряженной системы, т.е. для осуществления перехода с высшей заполненной (p-p) на низшую вакантную (p*+p*) орбиталь, требуется меньшая энергия, чем для возбуждения электронов изолированных двойных связей (p®p*), так что сопряженные двойные связи будут поглощать кванты света с большей длиной волны, чем изолированные двойные связи. С ростом числа сопряженных двойных связей энергия, необходимая для возбуждения электронов, будет уменьшаться, и поглощение света будет наблюдаться при больших длинах волн.
Интенсивность поглощения в спектре связана с вероятностью данного типа электронного перехода. Однако далеко не все переходы, формально кажущиеся возможными, осуществляются в действительности. Существуют так называемые правила отбора, определяющие разрешенные и запрещенные переходы. Эти правила учитывают в основном симметрию молекулы, а также электронную симметрию основного и возбужденного состояний; запрещены переходы, при которых происходит изменение спина электрона. Интенсивность поглощения, соответствующего разрешенным переходам, обычно высока, мольный коэффициент погашения достигает тысяч, а иногда и сотен тысяч единиц, тогда как для запрещенных переходов значение e составляет десятки, реже - сотни единиц.
Различные области спектра дают различную информацию. УФ спектры дают важную информацию о наличии кратных и сопряженных связей, ИК спектры позволяют наблюдать многочисленные проявления различных молекулярных группировок, ЯМР- и ЭПР- спектры позволяют исследовать тонкие детали механизмов взаимодействия в реакциях. Поэтому всегда важно использовать различные спектральные методы в комплексе.
Изучение УФ спектров
Электронные уровни наглядно и с высокой точностью описываются в терминах теории молекулярных орбиталей. Исходя из деталей взаимодействия и данных о потенциалах ионизации можно расположить электроны различных молекулярных орбиталей в следующий ряд по их энергии: s<p<n. s- орбитали занимают связывающие электроны всех типов органических молекул, p-орбитали заняты электронами двойных и тройных связей, n- орбитали заполняют электроны несвязывающих электронов гетероатомов, например, кислорода или азота. Возбуждение переводит электроны на более высокие разрыхляющие орбитали, энергия которых растет p*<s*. Таким образом, в электронных спектрах могут проявляться следующие переходы: n®p* (в карбонильных соединениях); p®p* (в алкенах, алкинах, карбонильных и азосоединениях); s®p* (в карбонильных соединениях); s®s* (в алканах).
Наличие и интенсивность проявления линии в спектре определяется вероятностью или разрешенностью соответствующего перехода. Для описания спектров используют следующие правила:
а) поглощение одного кванта сопровождается возбуждением одного электрона;
б) суммарное спиновое число при электронном переходе должно остаться неизменным.
Есть правила, учитывающие симметрию молекулы и симметрии основного и возбужденного состояний, но они не столь всеобщи. Во всех устойчивых молекулах электроны всегда спарены, возбуждение переносит электрон на более высокий по энергии уровень, но спин его остается противоположным спину электрона оставшегося. Системы, содержащие только спаренные электроны, называют синглетными; системы, в которых присутствуют неспаренные электроны - триплетными. Переходы между синглетными или триплетными уровнями разрешены и проявления в спектрах интенсивны (триплетные уровни заселены слабо и соответствующие линии слабы только поэтому), переходы между синглетным и триплетным уровнями, наоборот, запрещены и линии, им соответствующие, малоинтенсивны.
В молекулах можно выделить структурные фрагменты, обуславливающие избирательное поглощение излучение и называемые хромофорами и фрагменты, вступающие в электронное взаимодействие с хромофорами, изменяющие таким образом интенсивность поглощения и/или положение максимума и называемые ауксохромами. Выделяют следующие типы влияния ауксохрома:
а) батохромный сдвиг - смещение полосы поглощения в сторону более длинных волн (меньших частот) или красный сдвиг;
б) гипсохромный сдвиг - смещение в сторону более коротких волн (больших частот) или синий сдвиг;
в) гиперхромный эффект - увеличение интенсивности поглощения;
г) гипохромный эффект - понижение интенсивности поглощения
УФ спектр органического вещества характеристичен, так как поглощение определяется только собственно хромофором и его ближайшим окружением, т. е. один и тот же хромофор проявляется практически одинаково как в относительно простых, так и в самых сложных молекулах. В зависимости от непосредственного окружения одной и той же хромофорной группировки положение максимума поглощения в УФ спектрах различных соединений может несколько изменяться. Сдвиг максимума в сторону более длинных волн принято называть батохромным сдвигом, а сдвиг в сторону более коротких волн - гипсохромным. Замена растворителя в отдельных случаях может вызвать некоторые изменения как в положении полос (на 2- 10 нм), так и в их интенсивности (на 10-20%).
Как правило, такая замена влияет на спектры полярных веществ и практически не сказывается на УФ спектрах неполярных соединений. Наиболее сильные изменения в спектрах обусловлены химическим взаимодействием вещества с растворителем (в частности, образованием водородной связи), а также изменением степени диссоциации или соотношения таутомерных форм вещества. Во всех таких случаях следует проверить, выполняется ли для данного раствора закон Бугера-Ламберта-Бера.
Таким образом, УФ спектроскопия позволяет определить в исследуемых соединениях группировки-хромофоры и дает прекрасную возможность для количественного анализа веществ, содержащих такие группировки. Как структурно-аналитический метод УФ спектроскопия значительно менее информативна по сравнению с другими методами и носит в основном эмпирический характер, поскольку зависимость между характером поглощения и структурой молекулы не имеет строгого физико-математического обоснования, что, однако, не мешает широкому использованию метода.
Отсутствие в УФ спектре исследуемого вещества максимума поглощения в области 200-800 нм служит надежным доказательством того, что в этом веществе не содержатся сопряженные диеновые или полиеновые системы, ароматические ядра и карбонильные группы. Этот признак часто оказывается полезным при установлении структуры соединения, например, позволяет легко различить изомеры с сопряженными и изолированными двойными связями, как в случае приводимой ниже пары:

УФ спектры основных гетероциклических соединений представлены ниже:
| lмакс (в гексане) | ||
| фуран | 200 (e 10000) | 252 (e 1) |
| тиофен | 235 (e 4500) | |
| пиррол | 210 (e 15000) | 350 (e 300) |
| пиридин | 195 (e 7500) | 250 (e 2000) |
Таким образом, достаточно очевидны как преимущества метода (доказательство наличия в исследуемом веществе группировок-хромофоров сопряженной диеновой, полиеновой и ароматической систем, а также карбонильной группы или их отсутствия; в простейших случаях возможность определения типа хромофора, длины цепи сопряжения, числа алкильных групп при хромофоре; количественный анализ, включая регистрацию изменения концентраций растворов во времени), так и ограничения метода (ограниченность рамок применения, так как многие типы органических соединений не имеют максимума поглощения в исследуемой области; сравнительно малые возможности при решении структурно-аналитических задач; в ряде случаев сильное влияние природы растворителя на характер спектра и возможность отклонений от закона Бугера- Ламберта-Бера; фотохимическая изомеризация веществ в процессе работы (например, цис-транс- изомеризация в диеновых и полиеновых системах).
|
из
5.00
|
Обсуждение в статье: Спектроскопия в УФ- и видимом диапазонах |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

