 |
Главная |
Диффузионный потенциал
|
из
5.00
|
Потенциалы электродов
Задача 1. Цинковый электрод погружен в 0,1 н — раствор ZnSO4 при 20оС. Вычислить насколько изменится электродный потенциал цинка, если раствор сульфата цинка разбавить в 10 раз. Учесть, что средний коэффициентактивности электролита при этом увеличится от 0,40 до 0,64.
Ответ: DE = 0,023 В.
Задача 2. Окислительно — восстановительный потенциал системы Fe3+,Fe2+ в 0,1 н растворе HCl при отношении концентраций двух - и трехвалентных ионов железа, равном 106, составляет 0,387 В.
Вычислить стандартный потенциал окислительно — восстановительной системы при 20оС, если средние коэффициенты активности FeCl2 и FeCl3 в указанном растворе равны, соответственно, 0,33 и 0,08.
Ответ: E0 (Fe3+,Fe2+ ) = 0,77 В.
Задача 3. Стандартный электродный потенциал электрода Al |Al
при 25оС равен Е0 (Al3+/Al)= - 1,66 В. Вычислите активность иона Al3+ в растворе, при которой потенциал этого электрода по отношению к стандартному водородному электроду будет равен нулю.
Ответ: 1,42.1084.
Задача 4. Вычислить активность иона Cr3+ в растворе, при которой потенциал электрода Е (Cr3+/Cr)по отношению к стандартному водородному электроду равен нулю. Стандартный электродный потенциал электрода Cr3+, Сг равен - 0,71 В.
Ответ: 9,95 1011.
Задача 5. Потенциал свинцового электрода в 0,01 М растворе нитрата свинца относительно каломельного электрода равен –0,469 В при 298 К. Вычислите стандартный потенциал этого электрода относительно каломельного электрода. Средний коэффициент активности раствора равен 0,69.
Задача 6. Каково должно быть отношение активностей ионов Fe3+ и Fe2+, чтобы потенциалокислительно-восстановительного электрода Fe3+, Fe2+ | Pt пo отношению к стандартному водородному электроду был равен стандартному потенциалу электрода Сu2+, Cu | Pt? Значения стандартных потенциалов 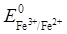 = 0,771 В и
= 0,771 В и 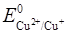 = 0,334 В.
= 0,334 В.
Задача 7. Чему равно отношение активностей ионов Tl3+ и Tl+, если равновесный потенциал электрода Tl3+, TI+ | Pt равен нулю, а стандартный потенциал этого электрода по отношению кстандартному водородному электроду равен +1,25 В?
Электрохимические цепи
Задача 8. Определить активность ионов кадмия в 0,025 молярном растворе K2CdI4, если ЭДС элемента:
( - ) Сd | K2Cdl4 (С = 0,025 M) | KCl (нас) | KCl (с = 0,1 н), Hg2Cl2 | Hg (+)
при 20оС равна 0,824 В. Потенциал децинормального каломельного электрода равен 0,336 В, а стандартный потенциал кадмиевого электрода (при активности ионов Cd , равной единице) составляет — 0,395 В.
Ответ: 7,2-10-4.
Задача 9. Вычислить при 25оС ЭДС цепи:
( - ) Hg, Hg2Cl2(ra) | KCl (1,0 н) | HCl (0,10 н), Cl2, Pt (+),
если pCl2 = 1 атм, а стандартные потенциалы хлорного и каломельного электродов равны, соответственно 1,358 В и 0,2828 В . Средний коэффициент активности 0,1 н раствора равен 0,796.
Ответ: Е = 1,135 В.
Задача 10. Вычислить ЭДС цепи:
( - ) Pt (H2) | HCOOH (С = 1 н) | KCl нас | СН3СООН (с = 0,5 н) | (Н2) Pt (+), если не принимать во внимание диффузионный потенциал. Константы диссоциации муравьиной и уксусной кислот равны, соответственно, 1,2710-4 и 1,8010-5.
Ответ: Е = 0,0178 В.
Задача 11. ЭДС цепи:
( - ) Pt (H2) |исследуемый раствор || KCl (с = 1 M), Hg2Cl2 | Hg (+) при 25оС равна 0,829 В.
Каково значение рН раствора, если стандартный потенциал нормального каломельного электрода равен при этой температуре равен 0,283 В.
Ответ: рН = 9,13.
Задача 12. ЭДС цепи:
( - ) Hg | Hg2Cl2 | KCl (с = 0,1 M)|| раствор (хингидрон) | Pt (+)
при 25оС равна 0,119 В.
Каково значение рН раствора, если стандартный потенциал нормального хингидронного электрода равен при этой температуре равен 0,699 В, а потенциал каломельного электрода в децинормальном растворе KCl равен 0,337 В?
Ответ: рН = 4,10.
Правило Лютера
Задача 13 Стандартные электродные потенциалы Cu+,Cu и Cu2+,Cu при 25оС равны 0,520 и 0,337 В.
Определить стандартный окислительно - восстановительный потенциал Cu2+,Cu+ - электрода.
Ответ: Eo = 0,154 В.
Задача 14. Стандартные потенциалы электродов Hg2+ ,Hg и Hg22+,2Hg при 25оС равны, соответственно, 0,860 и 0,796 В. Определите стандартный окислительно — восстановительный потенциал электрода Hg22+, 2Hg2+.
Ответ: - 0,924 В.
Определение ПР и Кн
Задача 15. Вычислить стандартный потенциал свинцового электрода, если при 25оС ЭДС цепи:
( - ) Pb | Pb(NO3)2 (с = 0,02 М) | Hg2Cl2, Hg (+)
равна 0,757 В, средний коэффициент активности Pb(NO3)2 равен в указанном растворе 0,62 и электродный потенциал нормального каломельного электрода равен 0,283 В
Ответ: Eo (Pb2+ |Pb) = - 0,126 B.
Задача 16. Стандартные электродные потенциалы: E 0(Pb2+/Pb) и
Eo (SO42-|PbSO4,Pb) равны при 25оС , соответственно, - 0,126 и - 0,355 В.
Составить цепь, написать реакции на электродах и общую реакцию в цепи и найти произведение растворимости соли PbSO4.
Ответ: Ls = 1,82.10-8.
Задача 17. Найдите произведение растворимости бромида серебра при 323 К, если при этой температуре стандартные потенциалы бромидсеребряного и серебряного электродов соответственно равны 0,046 и 0,749 В.
Задача 18 Стандартные электродные потенциалы при 25оС:
Е0 (Au +/Au) = 1,7 В и Е0 (Au(CNS)2-/Au) = 0,69 В.
Составить цепь, написать реакцию на электродах и общую реакцию в цепи и определить константу нестойкости комплекса Au(CNS)2-.
Ответ: Кн = 8,55.10-18.
Задача 19. Рассчитайте растворимость хлорида серебра в воде при 323 К, если при этой температуре ЭДС гальваническою элемента
Ag | AgCl (насыщ.р-р) | AgNO3 | Ag
(0,05 m)
равна 0,199 В, а коэффициент активности иона Ag+ в 0,05 т растворе нитрата серебра при 323 К составляет 0,9.
Диффузионный потенциал
Задача 20. Вычислить диффузионный потенциал на границе растворов:
NaCl (0,1 н) | NaCl (0,01 н)
при 18оС, если подвижности ионов Na+ и Сl- при этой температуре равны,
соответственно, 42,6 10-4 и 65,6 10-4 {См. м2-мольэкв-1- ).
Ответ: jd = 0,0122 В.
Задача 21. Вычислить диффузионный потенциал на границе растворов:
НCl (0,1 н) | NaCl(0,1 н)
при 25оС, если подвижности ионов H+ и Na+ при этой температуре равны, соответственно, 349,82,7 10-4 и 50,11 10-4 (См. м2-мольэкв-1-.).
Ответ: (jd = 0,0501 В.
Задача 22. Вычислить диффузионный потенциал на границе растворов:
K2SO4 (a = 0,1) | K2SO4 (a = 0,01)
при 25оС, если подвижности ионов K+ и 1/2 SO42- при этой температуре
равны, соответственно, 63,7 10- и 68,7 10- (См. м2-мольэкв-1-.).
Ответ: (jd = 0,022 B.
Задача 23. Вычислить диффузионный потенциал на границе растворов:
KCl (a = 0,1) | LiCl (a = 0,1)
при 25оС, если подвижности ионов К+ и Li+ при этой температуре
равны, соответственно, 73,52 10- и 38,62 10- (См. м2-мольэкв-1-.).
Ответ: jd = 0,0136 B.
Задача 24. Вычислить диффузионный потенциал на границе растворов:
CSNO3 (a = 0,1) | CSNO3 (a = 0,01)
при 18оС, если подвижности ионов Cs+ и NO3- при этой температуре равны,
соответственно, 66,8 10- и 62,6 10- (См. м2-мольэкв-1-.).
Ответ: jd = 0,0019 B.
Задача 25. Вычислить диффузионный потенциал на границе растворов:
HCl (a = 0,1) | LiCl (a = 0,1)
при 25оС. Подвижности ионов H+ и Li+ при этой температуре равны, соответственно, 349,82 10-4 и 38,69 10-4 (См. м2-мольэкв-1-.).
Ответ: jd = 0,0566 В.
Задача 26. Вычислить диффузионный потенциал на границе растворов:
LiCl (a = 0,1) |LiCl (a = 0,01)
при 18оC, если подвижности ионов Li + и Cl - при этой температуре равны,
соответственно, 32,6 10-4 и 65,5 10-4 (См. м2-мольэкв-1-.).
Ответ: jd = 0,0194 B.
Задача 27. Эдс цепи:
(-) Ag|AgCl, BaCl2 (m = 0,05)|BaCl2 (m = 0,01), AgCl|Ag (+)
при 25оС равна 0,02275 В. Коэффициенты активности ВаСl2 при m = 0,05 и m = 0,01 равны соответственно 0,564 и 0,716. Вычислить число переноса ионов Ва2+, считая его в интервале указанных концентраций постоянным.
Ответ: t(Ba2+) = 0,46.
Задача 28. Вычислить числа переноса ионов в растворах KI с моляльностями 0,01 и 0,1 при 25оС, если ЭДС цепи:
(-) K(Hg) |KI (m = 0,01) |KI (m = 0,1)|(Hg)K (+)
равна 0,05524 В, а ЭДС цепи:
(-) Ag|AgI, KI (m = 0,1)|KI (m = 0,01), AgI|Ag (+)
равна 0,05414 В.
Ответ: t. _ = 0,505; t„ + = 0,495.
Задача 29. Эдс цепи:
(-) Ag|AgCl, BaCl2 (m = 0,05)|BaCl2 (m = 0,01), AgCl|Ag (+)
при 25оС равна 0,02275 В. Коэффициенты активности ВаСl2 при m = 0,05 и m = 0,01 равны соответственно 0,564 и 0,716. Вычислить число переноса ионов Ва2+, считая его в интервале указанных концентраций постоянным.
Ответ: t(Ba2+) = 0,46.
Задача 30. Вычислить числа переноса ионов в растворах KI с моляльностями 0,01 и 0,1 при 25оС, если ЭДС цепи:
(-) K(Hg) |KI (m = 0,01) |KI (m = 0,1)|(Hg)K (+) равна 0,05524 В, а ЭДС цепи:
(-) Ag|AgI, KI (m = 0,1)|KI (m = 0,01), AgI|Ag (+) равна 0,05414 В.
Ответ: t. _ = 0,505; t„ + = 0,495.
Задача 31. ЭДС элемента
| (–) Cu | Cu(NO3)2 | Cu(NO3)2 | Cu (+) |
| с1 = 0,001 M с2 = ? |
при 298 К составляет 0,0891 В. Средние ионные коэффициенты активности растворов Cu(NO3)2 при концентрациях с1 и с2 равны соответственно 0,888 и 0,511. Рассчитайте концентрацию нитрата меди (с2) в католите.
Задача 32. Для нахождения числа переноса иона K+ использовали концентрационную цепь
(–) Нg, НgО | KОН | KОН | НgО(т), Hg (+)
с1 = 1,22 М с2 = 0,015 М
γ±1 = 0,75 γ±2 = 0,92
Вычислите числа переноса ионов K+ и ОН–, если ЭДС элемента, измеренная потенциометрическим способом, равна 0,058 В.
Задача 33. Определите числа переноса ионов Аg+ и NO3– в растворе AgNO3, если ЭДС гальванического элемента составляет 0,034 В:
(–) Ag | AgNO3 | AgNO3 | Ag (+)
с1 = 0,024 М с2 = 0,1 М
γ±1 = 0,86 γ±2 = 0,72
Зависимостью чисел переноса от концентрации пренебречь.
Задача 33. Рассчитайте число переноса Cl–, если ЭДС элемента равна 0,02 В:
(–) Рt | Н2 | НСl | НС1 | Н2 | Рt (+)
с1= 0,01 М с2 = 0,01 М
γ±1= 0,905 γ±2 = 0,89
Зависимостью чисел переноса от концентрации пренебречь.
Задача 34. С учетом диффузионных потенциалов вычислите рН раствора, если ЭДС элемента
(Pt) Н2 | KOH(aq) | KCl(aq) | HCl(aq) | H2 (Pt)
c1 = 0,001 М с2 = 0,001 М
γ± = 1 γ± = 1
составляет 0,417 В. Ионное произведение воды равно 1,2 · 10–14 при 291 К. Подвижности ионов водорода, хлора, калия, гидроксида соответственно равны 315; 65,5; 64,9 и 174 См ∙ см2 ∙ моль–1.
3.67. Вычислите произведение растворимости AgBr при 298 К, если ЭДС цепи
(–) Ag, AgBr | KBr(aq) | KCl(aq) | AgCl, Ag (+)
c1 = 0,1 M c2 = 0,1 M
при 298 К составляет 0,151 В. Произведение растворимости AgCl равно 1,56 · 10–10, молярные электрические проводимости KCl и KВr соответственно равны 128,9 и 131,8 См · см2 · моль-1 (молярные электрические проводимости даны для учета диффузионного потенциала).
|
из
5.00
|
Обсуждение в статье: Диффузионный потенциал |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

