 |
Главная |
Решение основных типов задач
|
из
5.00
|
Задача 1
Определить среднюю плотность и пористость камня, если водопоглощение его по объему составляет 21%, водопоглощение по массе – 15%, истинная плотность 2400 кг/м3.
Решение:
- Используя стандартные формулы определения водопоглощения по объему и массе, выполним следующие преобразования:
 (1);
(1);  (2),
(2),
Разделив первое выражение на второе получим W0 ρ в=Wm ρ m,, поскольку тс/V0= ρ m,
Далее, определяем среднюю плотность камня:

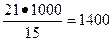 кг/м3,
кг/м3,
ρ m - средняя плотность камня;
ρ в - средняя плотность воды;
W0- водопоглощение по объему;
Wm- водопоглощение по массе.
- Определим пористость камня по формуле:
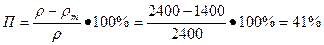 .
.
Задача 2
Определить коэффициент теплопроводности материала, имеющего среднюю плотность 1200 кг/м3 .
Решение:
Ориентировочно коэффициент теплопроводности - λ определяется по формуле В.П. Некрасова:
λ = 1,16  Вт/м 0С,
Вт/м 0С,
d- относительная плотность материала, d= ρ m/ ρ в ;
ρ m - средняя плотность материала;
ρ в - средняя плотность воды, равная 1000 кг/м3.
Подставим в формулу исходные данные и получим:
d = 1200/1000 = 1,2;
λ = 1,16  Вт/м 0С.
Вт/м 0С.
Задача 3
При стандартном испытании кирпича керамического на изгиб оказалось, что его предел прочности равен 4,2 МПа. Определить какое показание манометра пресса соответствовало этому напряжению, если площадь поршня пресса равен 50 см2
Решение:
Из формулы для расчета предела прочности при изгибе определяем значение показания манометра пресса:
 =
=  ;
;  =
= 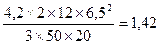 МПа,
МПа,
А – показание манометра пресса, МПа;
l – расстояние между опорами, см, l =20 см при стандартном испытании кирпича;
b, h – стандартные размеры ширины и толщины кирпича, см;
R – предел прочности при изгибе, МПа;
S – площадь поршня пресса, см2.
Задача 4
Определить какое количество глины по массе и по объему необходимо для получения 1000 шт. керамического кирпича со средней плотностью 1750 кг/м3 . Влажность глины 14 %, ее средняя плотность 1600 кг/м3, а потери при обжиге составляют 8 % от массы сухой глины.
Решение:
- Определяем массу 1000 шт кирпича:
Мк = ρ m Vк1000=1750(0,25 х 0,12 х 0,065)1000 = 3412,5 кг,
ρ m - средняя плотность кирпича, кг/м3;
Vк – объем кирпича, м3.
- Учитывая потери при обжиге, вычислим массу сухой глины:
Мсг = 3412,5(1+ 0,08) = 3685,5 кг.
- Определяем массу сырой глины с влажностью 14 %:
М = 3685,5(1+ 0,14) = 4201,5 кг.
- Определим объем сырой глины:
V = 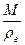 =
= 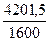 = 2,63 м3.
= 2,63 м3.
Задача 5
Определить расход составляющих материалов на 1 м3 тяжелого бетона со средней плотностью 2300 кг/м3 при В/Ц = 0,52 и номинальном составе по массе 1:2:4, если в момент приготовления бетонной смеси влажность песка была 4 %, а щебня 3 %.
Решение:
Масса 1 м3 плотной бетонной смеси равна сумме масс всех составляющих и численно равна средней плотности бетона. Если расход цемента принять за 1 часть, расход песка за 2 части, а щебня за 4 части, то сумма частей составит:
1 + 2 + 4 + 0,52 = 7,52.
Масса одной части или расход цемента составит:
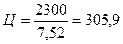 кг.
кг.
Зная номинальный состав бетона по массе, определим массу песка, щебня и воды на 1 м3 бетонной смеси:
П = 2 х 305,8 = 611,7 кг;
Щ = 4 х 305,8 = 1223,4 кг;
В = 0,52 х 305,8 = 159 л.
Требуемый состав бетонной смеси следующий:
Цемент – 305,8 кг
Песок – 611,6 кг
Щебень – 1223,2 кг
Вода – 159 л
На 1 м3 – 2300 кг
При использовании влажного песка и щебня для сохранения заданного В/Ц и расчетного количества песка необходимо дополнительно учесть воду, вводимую в смесь с песком и щебнем.
В 1 м3 бетонной смеси с песком поступит воды:
611,6 х 0,04 = 24,5 л;
с щебнем: 611,6 х 0,03 = 18,3 л,
т.е. больше расчетного на 18,3 + 24,5 = 42,8 л.
В то же время в 1 м3 бетонной смеси будет недоставать песка 24,5 кг и щебня 18,3 кг. Поэтому для получения бетона с заданными параметрами необходимо уменьшить расчетное количество воды на 42,8 л, а массу песка и щебня соответственно увеличить. Тогда рабочий состав бетонной смеси будет следующим:
Цемент – 305,8 кг
Песок – 611,6 + 24,5 =636,1кг
Щебень – 1223,2 + 18,3 = 1241,5 кг
Вода – 159 – 42,8 = 116,2 л
На 1 м3 – 2300 кг
Задача 6
Сколько можно получить извести-кипелки из 5 т известняка, содержащего в виде примеси 2% песка.
Решение:
Количество чистого известняка (без примесей) равно 5000х0,98=4900 кг; количество примесей 5000-4900=100 кг.
Образование извести происходит по реакции
CaCO3=CaO+CO2.
Молекулярный вес CaCO3=100; CaO=56.
Следовательно, можно составить пропорцию:
100 – 56
4900 – х х =  = 2740 кг
= 2740 кг
Так как примеси войдут в общий вес продукта, то количество полученной извести-кипелки (с примесями) будет
2740 кг + 100 кг = 2840 кг.
Задача 7
Для производства извести употребляется известняк, содержащий 3% песка, 2% глинистых веществ, 3% влаги.
Решение:
Общее содержание примесей составляет 3+2+3=8%; следовательно, чистого известняка будет 100-8=92%. Расчет ведем на 80 кг примесей и 920 кг CaCO3.
Из уравнения задачи 7 следует:
100 – 56
920 – х Х =  = 515 кг
= 515 кг
Из примесей, остающихся в извести, учитываем только песок и глинистые вещества, так как влага испарится. Таким образом, состав полученного продукта будет: CaO – 515 кг; примеси – 50 кг; итого 565 кг. Содержание CaO в смеси:
565 – 100%
500 – Х1 Х1 = 89%.
Согласно ГОСТ 9179 59 известь относится по содержанию активной CaO к I сорту (более 85%). Химически связанная вода в глинистых примесях не учитывалась.
Задача 8
На титрирование 1,1 г извести-кипелки израсходовано 35,3 мл 1н HCl. К какому сорту относится известь по содержанию активных CaO+MgO?
Решение:
Расчет ведется по формуле:
% (CaO + MgO) =  ,
,
где: n – количество мл 1н HCl, пошедших на титрирование навески извести;
g – навеска извести в г,
% (CaO + MgO) =  = 90%
= 90%
Согласно ГОСТ 9179-59 известь по содержанию активных CaO+MgO относится к I сорту.
Задача 9
Нормальная густота гипсового теста равна 59%. Сколько необходимо взять гипса и воды для получения 10 кг гипсового теста нормальной густоты.
Решение:
Если обозначить через «Х» необходимое количество гипса, то количество воды составит 0,59 х. В сумме должно быть 10 кг, т.е. х+0,59 х = 10
х = 10/1,59 = 6,3 кг
Воды необходимо взять 10 кг – 6,3 кг = 3,7 кг.
Задача 10
При просеивании 200 г строительного гипса остаток на сите № 02 составил 42 г. Какому сорту удовлетворяет гипс по тонкости помола.
Решение:
Остаток на сите № 02 в процентах к навеске составляет:
42/100 х 100 = 21%
Гипс относится ко II cорту, так как остаток на сите № 02 превышает 15%.
Задача 11
Сколько получится гипса-полугидрата и сколько растворимого ангидрита из 1 т гипсового камня, не содержащего примесей?
Решение:
Превышение гипсового камня в полугидрат идет по уравнению:
CaSO4×2H2O = CaSO4×0,5H2O+1,5H2O
Cоставляем пропорцию:
172 – 145
1000 – Х Х = 145 х 1000/ 172 = 850 кг
При образовании растворимого ангидрита из гипса удаляется вода вся, т.е.
CaSO4×2H2O = CaSO4×+ 2H2O
172 136
Отсюда пропорция:
172 – 136
1000 – Х Х = 136 х 1000/ 172 = 790 кг
Задача 12
Сколько квадратных метров сухой штукатурки толщиной 10,5 мм (без картона) можно получить из 10 т строительного гипса при затворении ею 60% воды, если средняя плотность сырого затвердевшего гипса равна 2100 кг/м3.
Решение:
Вес гипсового теста составит:
10 т + 0,6 х 10 т = 16 т.
Объем этого количества гипсового теста
16 т : 2,1 т/м3 = 7,6 м3.
При толщине 10,5 мм = 0,0105 м площадь сухой штукатурки, получаемой из этого объема гипсового теста, составит 7,6 м3 : 0,0105 м = 725 м2.
Задача 13
Сколько тонн каустического магнезита можно получить при обжиге 15 т магнезита, содержащего 8% (по массе) неразлагающихся примесей?
Решение:
Содержание чистого магнезита равно 15 т х 0,92 = 13,8 т и примесей 1,2 т. При обжиге магнезита происходит следующая химическая реакция:
MgCO3 = MgO+CO2,
84,3 40,3
где внизу проставлены молекулярные веса веществ, отсюда:
84,3 – 40,3
13,8 – Х Х = 6,6 т
Вместе с примесями вес каустического магнезита составит:
6,6 т + 1,2 т = 7,8 т.
Задача 14
Для получения магнезиального вяжущего расходуется (по массе) 65% чистого каустического магнезита (MgO) и 35% MgCl2×6Н2О в одном метре, чтобы получить 50 кг магнезиального вяжущего (в расчете на чистые компоненты).
Решение:
Определяем, сколько MgO и MgCl2×6H2O должно содержаться в 50 кг вяжущего:
50 – 100
Х – 65 Х = 50 х 65/ 100 = 32,5 кг
Количество
MgCl2×6H2O = 50 – 32,5 = 17,5 кг
Чтобы обеспечить это количество чистой MgO, необходимо взять 85% каустического магнезита:
32,5:0,85=38,2 кг
Раствора MgCl2×6Н2О необходимо взять:
17,5 кг : 0,410 = 37,8 литра.
Задача 15
Рассчитать, сколько MgCl2×6Н2О необходимо для затворения 10 кг MgO, если известно, что в процессе твердения 70% каустического магнезита гидратируется до Mg(OH)2 и 30% расходуется на образование оксихлорида магния 3MgO×MgCl2×6Н2О.
Решение:
На образование 3MgO×MgCl2×6H2O расходуется каустического магнезита 10 кг х 0,3 = 3 кг.
Расчет ведется по молекулярным весам: на три молекулы MgO (М=40,3) необходима одна молекула
MgCl2×6H2O (M=203,3).
Составляем пропорцию:
40,3 – 203,3
3 - Х Х = 15,2 кг
|
из
5.00
|
Обсуждение в статье: Решение основных типов задач |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

