 |
Главная |
Расчёт объёма продуктов горения
|
из
5.00
|
Запишем уравнение материального баланса процесса горения для каждого компонента данной смеси:
СО + 0,5О2 + 0,5∙3,76 N2 → СО2 + 0,5∙3,76 N2
С 2Н6 + 3,5О2 + 3,5∙3,76 N2 → 2СО2 + 3Н2О + 3,5∙3,76 N2
С5Н12 + 8О2 + 8∙3,76 N2 → 5СО2 + 6 Н2О + 8∙3,76 N2
Рассчитаем количество молей каждого продукта горения, образующегося при сгорании 1 моля смеси горючих веществ по формуле:

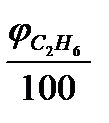
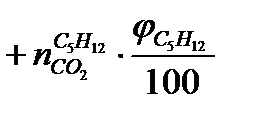 (1.1)
(1.1)
где  ,
,  ,
, 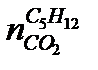 - число молей СО2, образующихся при сгорании соответствующего компонента;
- число молей СО2, образующихся при сгорании соответствующего компонента;
φСO, φC2H6, φC5H12 - процентное содержание каждого компонента в смеси горючих газов.
Подставляя численные значения в уравнение (1.1), получим:
 = 1∙ 0,75 + 2∙ 0,2 + 5∙ 0,05 = 1,4 моль/моль
= 1∙ 0,75 + 2∙ 0,2 + 5∙ 0,05 = 1,4 моль/моль
Аналогично найдём количество молей Н2О и N2 в продуктах горения:
nH2O= 3∙ 0,2 + 6∙ 0,05 = 0,9 моль/моль
n N2 = 3,76(0,5∙ 0,75 + 3,5∙ 0,2 + 8∙ 0,05) = 5,55 моль/моль.
При сгорании бедных смесей, т.е. содержащих избыточное количество воздуха, в продуктах горения, помимо СО2, Н2О и N2, будет содержаться воздух, не участвовавший в горении. Избыток воздуха находим из уравнения:
△nв = n0в (α -1) (1.2)
где n0в - теоретическое количество воздуха, необходимое для сгорания 1 моля смеси горючих веществ; α- коэффициент избытка воздуха.
Для определения теоретического количества воздуха можно воспользоваться уравнением расчёта общего количества молей кислорода и азота, т.е. воздуха, участвующего при сгорании каждого компонента горючей смеси.
n0в = ∑ (nO2i + nN2i) · 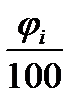 (1.3)
(1.3)
Из вышепредставленных уравнений материального баланса видно, что количество воздуха, необходимого для сгорания 1 моля смеси горючих газов равно:
n0в = (0,5 + 0,5·3,76)·  + (3,5 + 3,5·3,76) ·
+ (3,5 + 3,5·3,76) · 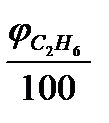 + (8 + 8 · 3,76) ·
+ (8 + 8 · 3,76) · 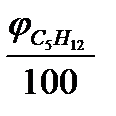 =
=
0,5· 4,76 ·0,75+ ,5·4,76·0,2+ 8·4,76 ·0,05 = 4,76·(0,5·0,75 + 3,5·0,2 + 8·0,05) = 7,02моль/моль.
Для смеси стехиометрического состава коэффициент избытка воздуха α = 1, а избыток воздуха △nв=0.
Для бедных смесей, содержащих избыточное количество воздуха, коэффициент α можно найти из соотношения:
 (1.4)
(1.4)
где φг - концентрация горючего в газо-воздушной смеси.
НКПР смеси горючих веществ находим по формуле Ле Шателье, а НКПР каждого отдельного горючего компонента можно найти по аппроксимационной формуле или взять из справочной литературы.
Аппроксимационная формула имеет вид:
 (1.5)
(1.5)
где по2 - число молей кислорода, необходимого для полного сгорания 1 моля горючего вещества; a и b - эмпирические коэффициенты, значения которых при определении  составляют a = 8,684 и b = 4,679.
составляют a = 8,684 и b = 4,679.
Выполним расчёты НКПР для каждого горючего вещества.
Для СО:
 = 11,1 % об.
= 11,1 % об.

 Величина по2 взята из уравнения материального баланса. Аналогично:
Величина по2 взята из уравнения материального баланса. Аналогично:
Справочные значения НКПР для СО, С2Н6 и C5H12 составляют 12,5; 2,9 и 1,47 % об. [2]. Как видно, они не очень сильно отличаются от расчётных величин. Для расчёта НКПР смеси горючих веществ будем использовать справочные значения, которые установлены экспериментально.
По правилу Ле-Шателье:
 (1.6)
(1.6)
где μi - объёмные доли соответствующего горючего компонента.
Подставляя численные значения μi и 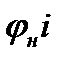 , получим:
, получим:

Стехиометрическую концентрацию горючего вещества определяют из соотношения
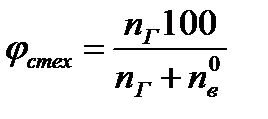 (1.7)
(1.7)
Для сгорания 1 моля смеси горючих веществ требуется 7,02 моля воздуха n0в.
Поэтому 
Для построения зависимостей Твзр=f(φг) и Рвзр=f(φг) необходимо определить значения Твзр и Рвзр при нескольких концентрациях горючего вещества.
Рекомендуется помимо φн и φстех выбрать следующие концентрации горючего вещества: 1,2 φн, 1,4φн и 0,8φстех. Для всех этих пяти значений концентрации горючего вещества необходимо рассчитать коэффициент избытка воздуха (α) по формуле 1.3, избыток воздуха (△nв) по формуле 1,2 и количество молей продуктов горения (nпг). Для примера приведём расчёты для концентрации горючего, равной НКПР (φн).

△nв = 7,02 · (2,18 -1,0) = 8,28 
Тогда полный объём продуктов горения
nпг = nСО2 + nН2О + nN2 + △nв
Подставляя численные значения, получим:
nпг = 1,4 + 0,9 + 5,55 + 8,28 = 16,13 
Аналогичные расчёты необходимо провести и для других концентраций горючего вещества.
Таблица 1.1- Результаты расчета выхода продуктов горения
|
|
из
5.00
|
Обсуждение в статье: Расчёт объёма продуктов горения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

