 |
Главная |
Медико-биологическое значение кондуктометрии
|
из
5.00
|
Кондуктометрией называют метод анализа, основанный на определении электрической проводимости жидких сред. Кондуктометрия применяется для:
– определения суммарного содержания электролитов в различных биологических средах (в плазме и сыворотке крови, желудочном соке, моче, тканевой жидкости);
– контроля качества минеральных вод и различных напитков;
– чистоты фармацевтических препаратов;
– качества посола мясных и рыбных консервов;
– степени чистоты воды, ионитов.
Кондуктометрия является одним из наиболее точных методов определения;
– констант диссоциации физиологически важных слабых электролитов;
– изоэлектрических точек α-аминокислот, пептидов, белков;
– проницаемости биологических мембран;
– для сравнения объема клеток и межклеточного пространства, (объема эритроцитов в крови).
Например, электрическая проводимость мочи в норме составляет 1,6 – 2,3 См/м. При заболеваниях почек (нефрит, нефросидероз, гломерулонефрит) электрическая проводимость может уменьшаться до 0,9 – 1,4 См/м, что связано с уменьшением концентрации NaCl и увеличением содержания белка в моче. При диабете электрическая проводимость также понижается до 0,9 – 1,4 См/м из-за повышения содержания сахара, являющегося неэлектролитом.
Перечисленные примеры относятся к методам прямой кондуктометрии. Кроме этого используют кондуктометрическое титрование для определения концентрации сильной кислоты, слабой кислоты, или каждой из них в их смеси.
Например, при титровании сильной кислоты (HCl) раствором NaOH идет реакция: H+ + Cl– + Na+ + OH– → H2O + Na+ + Cl–
До точки эквивалентности подвижные ионы Н+ заменяются на менее подвижные ионы Na+, поэтому электропроводность раствора уменьшается. После точки эквивалентности электропроводность возрастает из-за повышения концентрации ионов Na+ и OH-. Эквивалентный объём щелочи находится на оси абсцисс, куда опускают перпендикуляр из точки пересечения прямых электропроводности.
|
|

V экв. VNaOH
Потенциометрия.
Потенциометрия – это физико-химический метод анализа, основанный на измерении величины ЭДС гальванической цепи, составленной из двух электродов:
· Стандартного электрода (электрода сравнения);
· Измерительного электрода (электрода определения).
Оба электрода опущены в исследуемый раствор.

Рис. 6.3 Схема потенциометрического измерения.
Электроды
1) Общепринятым стандартным электродом является стандартный водородный электрод, потенциал которого принят равным нулю при любой температуре. Но из-за неудобства пользованием таким электродом на практике применяют обычно хлорсеребряный.

 Рис 6.4. Стандартный хлорсеребряный
Рис 6.4. Стандартный хлорсеребряный
Электрод.
Он состоит из серебряной проволоки, покрытой солью AgCl и опущенной в насыщенный раствор KCl. На межфазной границе протекает реакция восстановления.

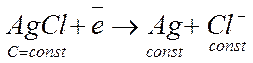
Концентрация всех компонентов в полу-реакции постоянны. Поэтому и потенциал этого электрода постоянен.
 относительно водородного
относительно водородного
|
Согласно уравнению Нернста, потенциалы этих электродов зависят от концентрации этих ионов в растворе.
 (6.11)
(6.11)
Принцип работы таких электродов основан на возникновении мембранного потенциала на мембране, встроенный в этот электрод. Эта мембрана имеет избирательную чувствительность к анализируемому иону. Мембраны бывают твёрдыми и жидкими.
 Чаще всего используют измерительный электрод с твёрдой мембраной – стеклянный электрод для измерения концентрации ионов Н + и величины pH.
Чаще всего используют измерительный электрод с твёрдой мембраной – стеклянный электрод для измерения концентрации ионов Н + и величины pH.
Рис 6.5.
|
из
5.00
|
Обсуждение в статье: Медико-биологическое значение кондуктометрии |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

