 |
Главная |
Электрометаллургия ферросиликомагния
|
из
5.00
|
Физико-химические свойства магния и его соединений. Магний – элемент ІІ группы Периодической системы элементов Д.И.Менделеева, атомный номер 12, атомная масса 24,305, относится к группе щелочноземельных металлов (ЩЗМ). Природный магний состоит из трех ста- бильных изотопов  Mg (78,60%),
Mg (78,60%),  Mg (10,11%) и
Mg (10,11%) и  Mg (11,29%). Конфигурация внешней электронной оболочки 3s2, степень окисления +2, очень редко +1.
Mg (11,29%). Конфигурация внешней электронной оболочки 3s2, степень окисления +2, очень редко +1.
Магний имеет гексагональную кристаллическую решетку (а = 0,3210 нм, с = 0,5200 нм). Температура плавления 650°С, плотность 1,74 г/см3 (20°С), 1,54 г/см3 (700°С). Теплота плавления ∆H  = 8,5 кДж/моль (650°С), энтропия S
= 8,5 кДж/моль (650°С), энтропия S  = 32,68 Дж/(моль×K). Уравнение температурной зависимости давления пара над жидким магнием имеет вид
= 32,68 Дж/(моль×K). Уравнение температурной зависимости давления пара над жидким магнием имеет вид
lgP (мм рт.ст.) = 16,7974 – 7844,2/Т + 2,548×10-4 Т –
– 2,7280 lgT (407 – 1390 K).
Система Mg–O. В системе Mg–O образуется оксид MgO*, температура плавления 2827оС, температура кипения 3600оС, плотность 3,58 г/см3. Энтальпия образования ∆H  = –601,50 кДж/моль, стандартная энтропия S
= –601,50 кДж/моль, стандартная энтропия S  = 26,95 Дж/(моль×K), теплоемкость С
= 26,95 Дж/(моль×K), теплоемкость С  = 37,24 Дж/(K×моль).
= 37,24 Дж/(K×моль).
Изменение энергии Гиббса реакций образования MgO из элементов характеризуется следующими уравнениями (в Дж/моль):
2MgT + O2 = 2MgOT; ∆G  = –1320746 + 214,44Т,
= –1320746 + 214,44Т,
2Mgж + O2 = 2MgOT; ∆G 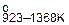 = –1216714 + 231,6Т,
= –1216714 + 231,6Т,
2Mgг + O2 = 2MgOT; ∆G  = –1453804 + 404,04Т.
= –1453804 + 404,04Т.
_________________________
* Известен природный минерал периклаз (оксид магния MgO) от греческих слов, буквально означающих «повсюду трещина» (за совершенную спайность по кубу).
Система Mg–C. Магний с углеродом образует карбиды MgC2 [∆Н  = –87,78 кДж/моль, S
= –87,78 кДж/моль, S  = 58,52 Дж/(моль×K)] и Mg2C3 [∆Н
= 58,52 Дж/(моль×K)] и Mg2C3 [∆Н  = –79,42 кДж/моль, S
= –79,42 кДж/моль, S  = 58,52 Дж/(моль×K)]. Плотность MgC2 равна 2,204 г/см3.
= 58,52 Дж/(моль×K)]. Плотность MgC2 равна 2,204 г/см3.
Изменения энергии Гиббса реакций образования карбидов магния в зависимости от температуры определяются по уравнениям (в Дж/моль):
2Mgж + 3Ств = Mg2C3тв; ∆G  = –57108 + 19,76T;
= –57108 + 19,76T;
Mgтв + 2Ств = MgC2тв; ∆G  = –87923 – 15,01Т.
= –87923 – 15,01Т.
При взаимодействии карбида магния с Н2О образуется С2Н2 и смесь углеводородов.
Система Mg–Si (рис. 18.9). C кремнием Mg образует силицид Mg2Si (63,44% Mg, 36,56% Si) с температурой конгруэнтного плавления 1102°С. Стандартные энтальпия образования Mg2Si ∆Н  = –79,2 кДж/моль, энтропия S
= –79,2 кДж/моль, энтропия S  = 67,8 Дж/(моль×K).
= 67,8 Дж/(моль×K).
Система Mg–S. При нагревании магний с серой образуют сульфид MgS – кристаллы с кубической решеткой, температурой плавления около 2200°С, плотностью 2,86 г/см3. Термодинамические свойства MgSтв: ∆Н  = –351,12 кДж/моль, S
= –351,12 кДж/моль, S  = 50,28 кДж/(моль×K). Изменение энергии Гиббса реакции образования MgS: Mg +
= 50,28 кДж/(моль×K). Изменение энергии Гиббса реакции образования MgS: Mg +  S2 = MgS имеет вид:
S2 = MgS имеет вид:
∆G  = –416537 + 95,30Т, Дж/моль (298-923 K).
= –416537 + 95,30Т, Дж/моль (298-923 K).
Система MgO–CO2. Карбонат магния MgCO3 [∆Н  = –1110,06 кДж/моль, S
= –1110,06 кДж/моль, S  = 65,32 кДж/(моль×K)] при нагревании диссоциирует по реакции:
= 65,32 кДж/(моль×K)] при нагревании диссоциирует по реакции:
MgCO3 ® MgO + CO2.
Система MgO–SiO2 (рис. 18.10). В системе образуются соединения 2MgO×SiO2 [∆Н  = –62,7 кДж/моль, S
= –62,7 кДж/моль, S  = 95,09 кДж/(моль×K)] и MgO×SiO2 [∆Н
= 95,09 кДж/(моль×K)] и MgO×SiO2 [∆Н  = –36,36 кДж/моль, S
= –36,36 кДж/моль, S  = 67,71 кДж/(моль×K)].
= 67,71 кДж/(моль×K)].
Рис. 18.9.Диаграмма равновесного состояния системы Mg–Si
Температурная зависимость изменения энергии Гиббса реакций образования силикатов из оксидов:
2MgO + SiO2 = 2MgO×SiO2;
∆G  = –63590 + 0,1Т (298–1700оС).
= –63590 + 0,1Т (298–1700оС).
MgO + SiO2 = MgO×SiO2;
∆G  = –37202 + 4,59Т (298–1600оС).
= –37202 + 4,59Т (298–1600оС).
Теплота плавления MgO×SiO2 ∆Н  = 61,5 кДж/моль, а 2MgO×SiO2 64,1 кДж/моль.
= 61,5 кДж/моль, а 2MgO×SiO2 64,1 кДж/моль.
Термодинамические свойства соединений наиболее важных для электрометаллургии магнийсодержащих ферросплавов обобщены в табл. 18.4.
Рис. 18.10. Диаграмма равновесного состояния системы MgO–SiO2
Таблица 18.4. Физико-химические свойства некоторых соединений магния
| Соедине-ния магния | –∆Н  ,
кДж
моль ,
кДж
моль
| –∆G  ,
кДж
моль ,
кДж
моль
| S  ,
Дж
(моль×К) ,
Дж
(моль×К)
| СP(298), Дж (моль×K) |
| MgO | 601,5 | 568,7 | 26,95 | 37,24 |
| Mg(OH)2 | 923,8 | 832,6 | 63,1 | 76,9 |
| MgS | 351,12 | 338,6 | 50,28 | 45,5 |
| MgCO3 | 1110,06 | 1011,1 | 65,32 | 76,0 |
| Mg2Si | 79,2 | 76,7 | 67,8 | 68,4 |
| MgSiO3 | 1547,4 | 1458,8 | 67,8 | 81,8 |
| Mg2SiO4 | 2169,8 | 2048,2 | 95,1 | 118,6 |
Минералы и руды магния. Магний в природе существует в виде различных минералов: карбонатов [MgCO3, (Ca, Mg)CO3], хлоридов (MgCl2×6H2O и др.), сульфатов (MgSO4×H2O и др.), силикатов (3MgO×2SiO2×2H2O), гидрата оксида магния Mg(OH)2, периклаза MgO и др. Мировое производство MgO основано на обжиге MgCO3, извлечении из морской воды или из рассолов. Причем, продукт обжига содержит 75–96% MgO, а из морской воды и рассолов – более 97%. В Ирландии мощности по производству MgO из морской воды составляют 90 тыс. т в год (2004 г.), в Израиле до 60 тыс. т в год.
Технология получения магния и магниевых ферросплавов. Основное количество чистого магния получают электролизом хлоридных соединений. Известны способы получения магния путем восстановления магния из MgO или обожженного доломита СаО×MgO в вакууме с использованием кремния (ферросилиция). Вакуум-термический процесс, в общем, описывается суммарной реакцией
2(СаО×MgO) + [Si]ФС75 = 2Mgгаз + (2СаО×SiO2)тв.
В зоне реакций Mg испаряется, а в охлаждаемой зоне металлической реторты (рис. 18.11) конденсируется. После охлаждения реторты магний извлекается в виде друз.
Рис. 18.11.Схема установки для получения магния силикотермическим
процессом в вакуумной реторте: 1 – реторта; 2 – кран; 3 – крышка
Наряду с кремнием (ферросилицием) в качестве восстановителя может использоваться алюминий.
Разработан и освоен силикотермический способ производства магния в виде ферросиликомагния путем восстановления магния кремнием ферросилиция при обычном давлении в дуговых ферросплавных печах. Шихта составляется из магнезита, извести, доломита, ферросилиция и плавикового шпата (СаF2). Процесс в общем виде может быть представлен схемой:
(MgO) + (CaO) + [Si]ФС75 ® [Ca–Mg–Si–Fe]спл. +
+ (СаО–MgO–SiO2)шл.
Максимальное содержание Mg в сплаве (2,3–2,6%) получают при соотношении в шихте MgO:СаО = 0,3 и СаF2: (СаО + MgO) = 0,1:0,15. Избыток плавикового шпата в шихте приводит к потере кремния вследствие протекания реакции
2СаF2 + Si = SiF4газ + 2Са.
Несмотря на освоенность приведенных выше способов получения чистого Mg и комплексного сплава системы Са-Mg-Si-Fe, на практике ферросиликомагний получают способом растворения чушкового магния, полученного электролитическим методом, в жидком ферросилиции*. По опыту ОАО «ЗФЗ» и других заводов на ОАО «Ключевской завод ферросплавов» разработана комбинированная технология получения магнийсодержащего ферросилиция. На первой стадии выплавляют в дуговой печи ДС-6Н1 с использованием шихты (ФС65, ФС75, СаО, магнезитовой крупки) сплав с 2,2–2,4% Mg, а на второй стадии доводят содержание Mg до 6–7% путем растворения в этом сплаве чушкового магния.
Ферросиликомагний содержит 5–7% Mg, 53–65% Si ост. железо. Недостатком этого способа является большой угар (потери) магния, световой эффект и интенсивное дымообразование.
|
из
5.00
|
Обсуждение в статье: Электрометаллургия ферросиликомагния |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

