 |
Главная |
Термические параметры состояния
|
из
5.00
|
Свойства рабочих тел характеризуются параметрами состояния. Термическими параметрами состояния являются: абсолютное давление p, абсолютная температура Т, удельный объем v.
1. Абсолютное давление (p) отсчитывается от 0. Избыточное давление (pu) отсчитывается от уровня атмосферного давления и измеряется манометром (жидкостным или пружинным). Атмосферное давление (pб) измеряется барометром. Приборы для измерения давления ниже атмосферного называются вакуумметрами и измеряют разрежение (pp).
Связи между абсолютным давлением p и давлениями, измеренными с помощью приборов,

| (1.1) |

| (1.2) |
наглядно подтверждаются рис. 1.1.
 В Международной системе единиц (СИ) давление выражается в паскалях (1Па = 1 Н/м2). Используются и другие единицы измерения давления (бар, мм рт. ст., ат…):
В Международной системе единиц (СИ) давление выражается в паскалях (1Па = 1 Н/м2). Используются и другие единицы измерения давления (бар, мм рт. ст., ат…):
1бар =105 Па=102 кПа = 0,1 МПа = 750 мм рт.ст.,
1ат = 1 кг/см2 = 735,6 мм рт. ст.,
1 физ. атм = 760 мм рт. ст.
2. Абсолютная температура T измеряется в градусах Кельвина (К)
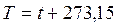 , ,
|
где t, 0C – температура в градусах Цельсия, определяемая с помощью термометров, пирометров, термопар и других приборов и устройств.
3. Удельный объем (v) – это объем единицы массы вещества
v=V/M, м3/кг, величина, обратная плотности v = 1/r.
Для сравнения термодинамических систем в одинаковых состояниях вводится понятие «нормальные физические условия»: p = 101,325 кПа (760 мм рт. ст.), T = 273,15 К (t = 0 0C).
Уравнение состояния
Связь между параметрами p, v, T называется термическим уравнением состояния

|
или
 . .
|
Эти уравнения показывают, что из трех параметров, определяющих состояние системы, независимыми являются два.
Конкретный вид уравнения состояния зависит от свойств веществ.
Для идеального газа термическое уравнение состояния имеет вид:

| (1.3) |

| (1.4) |

| (1.5) |

| (1.6) |
В уравнениях (1.3) – (1.6) используются следующие обозначения: p – абсолютное давление, Па; v – удельный объем, м3/кг; T – абсолютная температура, К; M – масса газа, кг; V – объем газа, м3; V 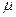 – объем 1 киломоля газа, м3/кмоль;
– объем 1 киломоля газа, м3/кмоль;  - число киломолей газа;
- число киломолей газа; 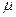 – мольная масса газа, кг/кмоль; Rm = 8314 Дж/(кмоль×К) – универсальная газовая постоянная; R =
– мольная масса газа, кг/кмоль; Rm = 8314 Дж/(кмоль×К) – универсальная газовая постоянная; R =  – газовая постоянная, Дж/(кг×К).
– газовая постоянная, Дж/(кг×К).
В реальных газах, в отличие от идеальных, существенны силы межмолекулярных взаимодействий, и нельзя пренебречь собственным объемом молекул. Термическое уравнение состояния реального газа можно представить в виде
 , ,
| (1.7) |
где  - коэффициент сжимаемости.
- коэффициент сжимаемости.
Вся сложность расчетов по уравнению (1.7) состоит в определении коэффициента сжимаемости. Реальные газы при T  ¥ или
¥ или  становятся идеальными, при этом z = 1.
становятся идеальными, при этом z = 1.
Понятие идеального газа является научной абстракцией, моделью реального газа, дающей хорошую сходимость с практикой. Для состояний газа, близких к состоянию сжижения (насыщенного пара) модель идеального газа неприемлема.
|
из
5.00
|
Обсуждение в статье: Термические параметры состояния |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

