 |
Главная |
Основные термодинамические процессы
|
из
5.00
|
Идеальных газов
Термодинамика в первую очередь рассматривает равновесные состояния и равновесные обратимые процессы, протекающие в идеализированных системах с бесконечно малыми скоростями течения процессов. Именно такие процессы поддаются графическому изображению и полному термодинамическому анализу, если известны свойства рабочего вещества.
Основными процессами, широко применяемыми в теоретических исследованиях и в технических разработках, являются:
1) изохорный ( v = const );
2) изобарный ( p = const );
3) изотермический ( T = const );
4) адиабатный ( dq = 0 );
5) политропный (обобщающий).
Если, пользуясь характеристическим уравнением состояния идеального газа, теорией теплоёмкости и первым законом термодинамики, провести исследования основных термодинамических процессов, то могут быть получены следующие зависимости и величины, характеризующие термодинамические закономерности изменения состояния газов.
1.Уравнение процесса в системе координат p – v .
2.Аналитическая взаимосвязь между основными параметрами процесса ( p, v, T ).
3.Теплоёмкость процесса.
4.Величина изменения внутренней энергии газа.
5.Величина изменения энтальпии.
6.Работа процесса, совершаемая рабочим телом (газом) или внешней средой.
7.Количество тепла, подведённого за время процесса к рабочему телу, или отведённого от него.
Следует отметить, что действительные процессы, протекающие в природе и в технике, сопровождаются внутренним и внешним трением газа при конечных скоростях его движения и конечной разности температур, а, следовательно, не являются обратимыми. Однако многие реальные процессы сравнительно мало отличаются от идеальных (обратимых) и в расчётах их принимают за равновесные. Для остальных же в расчётные зависимости приходится вносить соответствующие корректирующие поправки (поправочные коэффициенты) из справочной литературы.
Далее приводятся расчётные зависимости и величины для основных процессов идеальных газов, исходя из условия, что теплоёмкости газов не зависят от температуры и остаются постоянными.
Примечание. При больших изменениях температуры расчёт газовых процессов следует вести с учётом зависимости теплоёмкости от температуры, используя справочные таблицы (см. раздел 5).
Изохорный процесс
Процесс, протекающий при постоянном объёме ( dv = 0, или v = const ), называют изохорным.
Уравнение процесса
p = 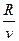 T . (7.1)
T . (7.1)
Графическую линию процесса называют изохорой.
Зависимость между параметрами описывается законом Шарля (давления пропорциональны температурам):
 =
= 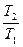 . (7.2)
. (7.2)
Теплоёмкость процесса – c  , кДж / (кг град).
, кДж / (кг град).
Изменение внутренней энергии одного кг газа
 u = u
u = u  - u
- u  = c
= c  ( T
( T  - T
- T  ), кДж / кг. (7.3)
), кДж / кг. (7.3)
Внешняя работа процесса при v = const, когда dv = 0,
l =  = 0. (7.4)
= 0. (7.4)
|
из
5.00
|
Обсуждение в статье: Основные термодинамические процессы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

