 |
Главная |
Количественное определение пероксида водорода перманганатометрическим методом (прямое титрование)
|
из
5.00
|
Ход работы: 10 мл препарата помещают в мерную колу вместимостью 100мл, доводят объем раствора до метки. К 10мл полученного раствора прибавляют 5мл Н2SO4(разб) и титруют раствором перманганата калия 0,1 моль/л до слабо-розового окрашивания.
Прямое титрование:
 5H2O2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5O2 + 8H2O
5H2O2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5O2 + 8H2O
H2O2-2ē → 2H++O2 5
MnO4- + 8H+ + 5e→Mn2+ +4H2O 2
5H2O2 + 2MnO4- + 16H+ → 10H+ + 5O2 + 2Mn2+ + 8H2O
n(½H2O2) = n(1/5 KMnO4)
c(½H2O2) =c (1/5 KMnO4)·V(1/5 KMnO4)/V(½H2O2)
m(H2O2)= C (½H2O2) ∙M(½H2O2) V
w(H2O2)= m(H2O2)/ m(р-ра)
с(½H2O2) =  = 0,151 моль/л
= 0,151 моль/л
m(H2O2) = 0,151моль/л ∙ 17г/моль ∙ 0,1л = 0,085г
w(H2O2) = 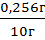 = 2,56%
= 2,56%
Сравнение двух методов анализа по правильности и воспроизводимости
Объем титранта, пошедший на титрование H2O2
| V(Na2S2O3), мл | V (KMnO4), мл | |
| 4,9 | 14,5 | |
| 5,0 | 14,6 | |
| 5,0 | 14,7 | |
| 5,0 | 14,7 | |
| 5,0 | 14,8 | |
| 5,1 | 14,9 | |
| 5,1 | 14,9 | |
| 5,1 | 14,9 | |
| 5,2 | 15,0 | |
| 5,2 | 15,1 | |
| 5,3 | 15,2 | |
| 5,4 | 15,3 |
Исходя из объема титранта, пошедшего на титрование, вычисляем массовую долю пероксида водорода:
| w(H2O2) заместительное титрование | w(H2O2) прямое титрование | |
| 2,77 | 2,90 | |
| 2,83 | 2,94 | |
| 2,83 | 2,94 | |
| 2,83 | 2,94 | |
| 2,83 | 2,96 | |
| 2,89 | 2,98 | |
| 2,89 | 2,98 | |
| 2,89 | 2,98 | |
| 2,94 | 3,00 | |
| 2,94 | 3,02 | |
| 3,00 | 3,04 | |
| 3,06 | 3,06 |
Охарактеризуем заместительное титрование по воспроизводимости и правильности. Определяем наличие грубых промахов:
Q1 =  = 0,2
= 0,2
Q2 =  = 0,2
= 0,2
Qтаб = 0,64 ; Qрасч = 0,2 < Qтаб = 0,64
Грубые промахи отсутствуют. Выборка однородна.
w(ср) =  = 2,89%
= 2,89%
Таблица отклонений
| w | ∆w | ∆w2 |
| 2,77 | -0,12 | 0,0144 |
| 2,83 | -0,06 | 0,0036 |
| 2,83 | -0,06 | 0,0036 |
| 2,83 | -0,06 | 0,0036 |
| 2,83 | -0,06 | 0,0036 |
| 2,89 | 0,00 | 0,0000 |
| 2,89 | 0,00 | 0,0000 |
| 2,89 | 0,00 | 0,0000 |
| 2,94 | 0,05 | 0,0025 |
| 2,94 | 0,05 | 0,0025 |
| 3,00 | 0,11 | 0,0121 |
| 3,06 | 0,17 | 0,0289 |
∑∆w2 = 0,0748
Рассчитываем стандартное отклонение и дисперсию.
 S = √∑∆w2 /(n-1) = 0,0825
S = √∑∆w2 /(n-1) = 0,0825
V = S2 = 0,006806
Рассчитываем полуширину доверительного интервала.
∆w(ср) = S∙t 0,95∙12 = 0,0825 ∙2,20 = 0,052


Доверительный интервал:
w(ср) ±∆w(ср) = 2,89 ± 0,052
Рассчитываем относительную ошибку среднего
ὲ =  = 1,799%
= 1,799%
Охарактеризуем прямое титрование по воспроизводимости и правильности:
Определяем наличие грубых промахов
Q1 =  = 0,125
= 0,125
Q2 =  = 0,125
= 0,125
Qтаб = 0,64 ; Qрасч = 0,125 < Qтабл = 0,64
Грубые промахи отсутствуют. Выборка однородна.
w(ср)=  =2,98%
=2,98%
Таблица отклонений
| w | ∆w | ∆w2 |
| 2,90 | -0,08 | 0,0061 |
| 2,94 | -0,04 | 0,0015 |
| 2,94 | -0,04 | 0,0015 |
| 2,94 | -0,04 | 0,0015 |
| 2,96 | -0,02 | 0,0003 |
| 2,98 | 0,00 | 0,0000 |
| 2,98 | 0,00 | 0,0000 |
| 2,98 | 0,00 | 0,0000 |
| 3,00 | 0,02 | 0,0005 |
| 3,02 | 0,04 | 0,0017 |
| 3,04 | 0,06 | 0,0038 |
| 3,06 | 0,08 | 0,0067 |
∑∆w2= 0,0236
 Рассчитываем стандартное отклонение и дисперсию.
Рассчитываем стандартное отклонение и дисперсию.
S= √∑∆w2 /(n-1) =0,046
V= S2 = 0,002
Рассчитываем полуширину доверительного интервала.
∆w(ср) = S∙t 0,95∙12 = 0,046 ∙2,20 = 0,029


Доверительный интервал:
w(ср) ±∆w(ср) = 2,97 ± 0,029
Рассчитываем относительную ошибку среднего
ὲ=  =0,97%
=0,97%
Итоговая таблица
| Заместительное титрование | Прямое титрование | |
| w | 2,77; 2,83; 2,83; 2,83; 2,83; 2,89; 2,89; 2,89; 2,94; 2,94; 3,00; 3,06 | 2,90; 2,94; 2,94; 2,94; 2,96; 2,98; 2,98; 2,98; 3,00; 3,02; 3,04; 3,06 |
| n | ||
| f | ||
| w(ср) | 2,89 | 2,98 |
| V | 0,006806 | 0,002 |
| S | 0,825 | 0,046 |
| ∆w | 0,052 | 0,029 |
| w(ср)±∆w(ср) | 2,89 ± 0,052 | 2,97 ± 0,029 |
| ὲ | 1,79% | 0,97% |
Сравним дисперсии обоих методов, рассчитав критерий Фишера
Fрасч= V1/V2 = 0,006806/0,002 = 3,403
Fтаб = 4,47 ; Fрасч< Fтаб
Различие дисперсий статистически не значимо. Дисперсии однородны.
Методы сравнимы по воспроизводимости.
Сравним средние результаты, полученные двумя методами анализа.
Выше было показано, что оба метода дают правильные результаты и следовательно результаты полученные обоими методами можно рассматривать как единую выборку, т.к. дисперсии V1 и V2 однородны, то рассчитаем средневзвешенную дисперсию:
V(ср)= S(ср)2= (n1-1)∙V1+(n2-1)∙V2 = 0,006806∙11+0,002∙11 = 0,004403
n1+n2 -2 22
Вычисляем критерии Стьюдента:

 tрасч= |w1(ср)- w2(ср)| ∙
tрасч= |w1(ср)- w2(ср)| ∙  = 0,09 ∙
= 0,09 ∙  = 3,32
= 3,32
 0,0664
0,0664
tтабл = 3,7 при p=0,999 и n = n1+n2=22 ; tрасч < tтабл
Различие между средним w1(ср) и w2(ср), т.е. между результатами, полученными двумя разными методами анализа, статистически незначимо. Данные, найденные обоими методами, можно объединить в единую выборку объёмом n1+n2 и обрабатывать как единую выборочную совокупность вариант.
VII. ЛИТЕРАТУРА ДЛЯ САМОПОДГОТОВКИ
1. Харитонов Ю.Я. Аналитическая химия (аналитика). В двух книгах. Количественный анализ. Физико-химические (инструментальные) методы анализа. М.: Высшая школа, 2008.
2. Васильев В.П. Аналитическая химия. В двух книгах. Титриметрический и гравиметрический методы анализа. М.: Высшее образование, 2004.
3. Основы аналитической химии / под редакцией академика Ю.А. Золотова. Кн. 2. Методы химического анализа. М.: Высшая школа, 2002.
4. Алексеев В.Н. Количественный анализ. М.: Химия, 1972. 5. Шемякин Ф.М. Аналитическая химия. М.: Высшая школа, 1982.
6. Крешков А.П. Основы аналитической химии. Т. 2. М.: Химия, 1971.
7. Конспекты лекций.
Оглавление
Введение. 3
Окислительно-восстановительные процессы.. 4
I. Окислительно-восстановительные реакции. 4
1.1.Расчет коэффициентов в уравнениях окислительно-восстановительных реакций на основе электронного баланса. 4
1.2.Расчет коэффициентов уравнений окислительно-восстановительных реакций с помощью ионно-электронных схем.. 6
II.Продукты окислительно-восстановительных реакций. 10
2.1.Окислители. Окислители - элементарные вещества. 11
2.2.Окислители - кислородные кислоты, преимущественно высшие, и их соли. 12
2.3.Окислители — соединения, содержащие Н+ и металлы в высшей степени окисления Fe(NO3)3, MnO2, РbO2 15
2.4.Восстановители. Восстановители — элементарные вещества. 17
2.5.Восстановители — низшие кислородные кислоты и их соли. 17
2.6.Восстановители — соединения металлов в низшей положительной степени окисления. 18
2.7.Восстановители — соединения неметаллов, имеющих отрицательные степени окисления 19
2.8.Окислительно-восстановительная двойственность. 19
2.9.Реакции диспропорционирования и репропорционирования. 21
III. ЭКВИВАЛЕНТЫ И МОЛЯРНАЯ КОНЦЕНТРАЦИЯ ЭКВИВАЛЕНТОВ ОКИСЛИТЕЛЕЙ И ВОССТАНОВИТЕЛЕЙ.. 21
IV.ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ.. 22
4.1.Сущность метода. 22
4.2.Классификация редокс-методов. 23
4.3.Условия проведения окислительно-восстановительного титрования. 24
4.4. Виды окислительно-восстановительного титрования (прямое, обратное, заместительное) и расчеты результатов титрования. 25
4.5. Индикаторы окислительно-восстановительного титрования. Классификация индикаторов 27
4.6. Окислительно-восстановительные индикаторы (обратимые и необратимые), интервал изменения окраски индикатора. 29
4.7. Примеры окислительно-восстановительных индикаторов, часто применяемых в анализе (дифениламин, N-фенилантраниловая кислота, ферроин). 30
V. ПРИМЕРЫ И ЗАДАЧИ ПО ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОМУ ТИТРОВАНИЮ... 31
5.1. Перманганатометрия. 31
5.2. Дихроматометрия. 34
5.3. Йодометрия и хлориодиметрия. 34
VI. ПРИМЕР ОФОРМЛЕНИЯ ЛАБОРАТОРНОЙ РАБОТЫ С МАТЕМАТИЧЕСКОЙ ОБРАБОТКОЙ РЕЗУЛЬТАТОВ АНАЛИЗА. СРАВНЕНИЕ ДВУХ МЕТОДОВ ПО ВОСПРОИЗВОДИМОСТИ И ПРАВИЛЬНОСТИ.. 39
6.1. Окислительно - восстановительное титрование. Приготовление и стандартизация раствора нитрита натрия. 39
6.1.1. Стандартизация по сульфаниловой кислоте. 39
6.1.2. Стандартизация по перманганату калия. 39
6.2. Йодометрическое титрование. Определение пероксида водорода заместительным титрованием 44
6.2.1. Количественное определение пероксида водорода перманганатометрическим методом (прямое титрование). 45
VII. ЛИТЕРАТУРА ДЛЯ САМОПОДГОТОВКИ.. 50
|
из
5.00
|
Обсуждение в статье: Количественное определение пероксида водорода перманганатометрическим методом (прямое титрование) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

